Как известно, протеины представляют собой макромолекулы, обычно из 20 аминокислот, соединенных между собой пептидными связями. После поступления в ЖКТ млекопитающих они подвергаются гидролизу с образованием более мелких фрагментов, называемых пептидами, а на конечном этапе переваривания образуют короткие пептиды (две-три-четыре аминокислоты в связке) и свободные аминокислоты. Промышленная обработка протеинов различными способами также приводит к расщеплению протеинов до пептидов и аминокислот, что облегчает в последующем переработку такой формы в организме человека. Существует много методов воздействия на протеины с целью получения гидролизатов, каждый из которых создает определенную композицию пептидов и аминокислот (Hou Y. et al., 2017), но для получения продуктов с целью терапевтического применения может быть использован лишь энзиматический (ферментативный) метод. В целом, в большинстве гидролизатов белков преобладают пептиды со средней и большой длиной аминокислотной цепи, что относится и к вариантам совместного применения нутрицевтиков на основе протеинов с протеолитическими ферментами in vivo (системная энзимотерапия — СЭТ). Но чем глубже промышленный гидролиз протеинов, тем больше доля коротких пептидов (ди-, три- и тетрапептидов) в гидролизате. С точки зрения клинической фармакологии это означает снижение роли белкового субстрата как нутриента и увеличение регуляторной роли коротких пептидов в метаболических процессах как самостоятельных фармакологических агентов. Типичный пример определения пептидно-аминокислотного состава гидролизата whey-протеина (WPH) в процессе гидролитического расщепления показан на рис. 1.
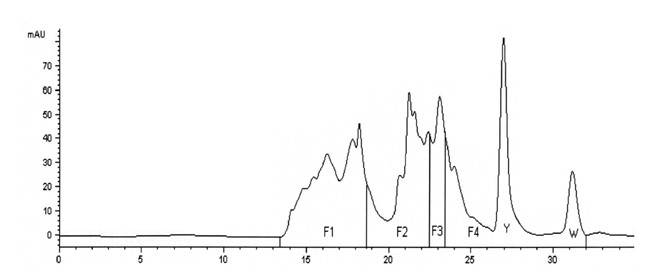
Рисунок 1. Хроматографический профиль WPH (гидролизат whey-протеина) (цит. по: Silvestre M.P.C. et al., 2012): F1 — большие пептиды (> 7 аминокислот); F2 — средние пептиды (4–7 аминокислот); F3 — ди- и трипептиды; F4 — свободные аминокислоты; Y — пик тирозина; W — пик триптофана; концентрация субстрата 10%, фермент — панкреатин, время гидролиза — 5 часов, температура ‒ 50°C, рН = 7,0; по оси абсцисс время в минутах, по оси ординат — оптическая плотность (mAU — milliAdsorbentUnit)
Функциональные и нутритивные свойства протеиновых гидролизатов определяются качественными и количественными параметрами пептидов, распределением молекул с разным молекулярным весом, что традиционно определяется хроматографически (Size Exclusion Chromatography). Существуют усовершенствованные методы определения низкомолекулярных пептидов с молекулярной массой до 1000 Da (Silvestre M.P.C. et al., 2012). Безусловно, профиль пептидов и аминокислот гидролизата зависит от используемых принципов ферментативной обработки (выбор ферментов и условий) и исходного субстрата. Как видно из рис. 1, по времени из WPH выделяются 4 фракции: F1 — на 13,5–18,5 мин (большие пептиды, содержащие более 7 аминокислот); F2 — на 18,5–22,5 мин (средние пептиды, содержащие от 4 до 7 аминокислот); F3 — на 22,5–23,5 мин (ди- и трипептиды); F4 — на 23,5–32 мин — свободные аминокислоты. Из данных литературы известно, что в организме первая стадия гидролиза приводит к образованию олигопептидов, которые содержат от 2 до 6 аминокислот и свободных аминокислот (Frenhani P.B., Burini R.B., 1999). Затем эти пептиды разрушаются с образованием ди- и трипептидов, которые и абсорбируются вместе со свободными аминокислотами. С клинической точки зрения чрезвычайно важно, что, по мнению этих авторов, абсорбция ди- и трипептидов происходит более эффективно, чем свободных аминокислот, которые, в свою очередь, абсорбируются лучше пептидов с большим молекулярным весом. С этим мнением согласен и другой автор (Schaafsma G., 2009), который пришел к выводу о десятикратном преимуществе по скорости всасывания смеси ди- и трипептидов по сравнению со смесью свободных аминокислот. На этом основании был сделан очень важный вывод: выбор наиболее качественного в практическом плане гидролизата должен основываться на высоком количестве ди- и трипептидов (не менее 15–16%) и свободных аминокислот (около 47–48%) при относительно небольшом количестве пептидов с большим молекулярным весом (около 25–26%).
Гидролитическое расщепление растительных белков (вегапротеинов) может обеспечить в продукте высокий процент коротких пептидов и соответствующую метаболическую активность питательных смесей для всех без исключения групп населения, включая веганов и вегетарианцев, лиц с непереносимостью молочных белков. Это может, как показывают клинические исследования, компенсировать меньшее содержание ВСАА и в первую очередь лейцина.
Короткие пептиды не только легче абсорбируются стенками кишечника, но и, по ряду данных (Zhanghi B.M., Matthews J.C., 2010), имеют свои специфические транспортные механизмы переноса через кишечный барьер в кровяное русло. Это важный момент в метаболизме коротких пептидов, который определяет их дальнейшую судьбу. В тонком кишечнике существует пептидный транспортер (PЕРT1), ответственный за протонзависимый транспорт внеклеточных ди- и трипептидов через апикальную мембрану энтероцитов внутрь этих клеток (Zhanghi B.M., Matthews J.C., 2010). Однако из-за высокой активности внутриклеточных пептидаз эпителия тонкого кишечника кажется маловероятным, чтобы сколько-нибудь значимое для питания количество коротких пептидов в просвете кишки могло попасть непосредственно в портальную вену или лимфатическую систему. Вполне вероятно, что какое-то определенное, но достаточно ограниченное количество пептидов абсорбируется в неизмененном виде из кишечника в кровь посредством М-клеток, экзосом и энтероцитов с помощью трансэпителиального клеточного транспорта (Gardner M.L., 1982; Gardner M.L., Wood D., 1989). Пептиды, поступающие с пищей, также могут активировать рецепторы сигнальных путей, связывающих кишечник с другими внутренними органами, эндокринной, гормональной и иммунной системами, оказывая влияние на весь организм.
Последовательность действия коротких пептидов в организме после приема внутрь примерно такова: 1) участие в метаболизме тканей кишечника (энтероциты), поскольку именно эти клетки забирают очень значительную долю пептидов и аминокислот из пищи для обеспечения собственных потребностей; 2) участие в пристеночном пищеварении; 3) сигнальные функции — воздействие на рецепторы кишечника и активация осей «кишечник — мышцы» и «кишечник — мозг»; 4) использование микробиома толстого кишечника для его собственной деятельности и выработки ряда незаменимых нутриентов, витаминов и других БАВ; 5) транспортировка к органам и тканям в частично неизмененном виде для дальнейшего метаболизма и даже проникновение через ГЭБ в мозг (нейромодуляторные и нейрометаболические эффекты); воздействие пептидов на рецепторные вне- и внутриклеточные и метаболические процессы самых разных органов и тканей. В медицинской науке устоялся термин «тканеспецифическая пептидная регуляция функции клеток» (Хавинсон В.Х. и соавт., 1988; Малинин В.В., 1992; Морозов В.Г. и соавт., 2000; Хавинсон В.Х., Кветная Т.В, 2005), который используется, в частности, для исследования клеточного иммунитета, процесса воспаления и регенерации, то есть тех основополагающих механизмов, которые постоянно работают в организме спортсмена.
Чрезвычайно важно, что образование и действие пептидных факторов — такой же обычный природный метаболический процесс, как и функционирование аминокислот, и попытка объяснения получаемых результатов только с позиции взаимодействия аминокислот с соответствующими рецепторами клеток, включения аминокислот во внутриклеточный метаболизм не могут считаться удовлетворительными.




