В настоящее время большой интерес представляет изучение свойств пептидов [Dudgeon W.D. et al., 2016]. Пептиды имеют ту же структуру, что и белки (протеины), но размер этих молекул меньше. Важно также отметить, что короткие пептиды, являясь естественным продуктом обмена веществ, присутствующих в организме, не могут быть выявлены в крови или моче. В связи с этим интерес представляет изучение свойств отдельных структур на клеточных культурах.
Пептид IPH-AGAA содержит низкомолекулярный пептид, обладает миопротекторными свойствами и оказывает нормализующее действие на мышечную ткань.
Экспериментальные исследования показали, что пептид IPH-AGAA регулирует процессы метаболизма в миоцитах, повышает резервные возможности организма, что позволяет предполагать эффективность применения пептида IPH-AGAA для нормализации функций мышечной системы человека при нарушениях различного генеза.
В связи с этим целью нашего исследования было изучение миопротекторных и других свойств пептида.
Дизайн исследования
1 этап.
Для оценки цитостатических и онкопротекторных свойств пептида IPH-AGAA в отношении мышечной системы нами были выбраны эмбриональные стволовые клетки (ЭСК), которые относятся к плюрипотентному типу, это значит, что они могут дифференцироваться во все три первичных зародышевых листка: эктодерму, энтодерму и мезодерму, из которых в дальнейшем образуются ткани мышечной системы. Эмбрион человека достигает стадии бластоцисты, из которой получают стволовые клетки, спустя 5-6 дней после оплодотворения.
Гены, ответственные за формирование мышечной ткани,- ген ACTN3 и ген MSTN.
Ген ACTN3 кодирует белок альфа-актинин-3 (ACTN3), который стабилизирует сократительный аппарат скелетных мышц и участвует в большом количестве метаболических процессов. Локализация гена на хромосоме – 11q13.2. В быстрых мышечных волокнах синтезируется белок альфа-актинин-3, который кодируется геном ACTN3. Альфа-актинин-3 стабилизирует сократительный аппарат скелетных мышц и участвует в различных метаболических процессах. В результате нонсенс-мутации кодон, кодирующий аминокислоту аргинин, преобразуется в стоп-кодон и синтез полипептидной цепи белка останавливается, что влечет за собой отсутствие в мышцах белка альфа-актинина-3. На этом основании предполагают, что полиморфизм гена ACTN3 является одной из причин изменения метаболизма (обмена веществ) в мышечной ткани и снижения уровня развития скоростно-силовых качеств у человека. В связи с этими данными нами было принято решение изучить активность данного гена при применении пептида IPH-AGAA.
У человека миостатин закодирован в гене MSTN закодирован миостатин. Миостатин (фактор роста и дифференцировки 8) — белок, который подавляет рост и дифференцировку мышечной ткани. Экпериментальные исследования показывают, что блокирование действия миостатина приводит к значительному увеличению сухой мышечной массы с практически полным отсутствием жировой ткани. Миостатин активен в скелетных мышцах, выделяется в кровь, оказывая свое действие на мышцы за счет связывания с рецепторами ACVR2B (activin type II receptor), до и после рождения. Это обычно ограничивает рост мышц, гарантируя отсутствие гипертрофированной мышечной ткани. В связи с этими данными нами было принято решение изучить активность данного гена при применении пептида IPH-AGAA
Нами была произведена оценка экспрессия генов, отвечающих за онтогенез мышечной системы.
2 этап.
Вторым этапом нашего экспериментального исследования была оценка маркерных биологических активных молекул иммунофлуоресцентным методом с использованием первичных антител к Mif5 (1:150, Abcam), к ACTN3 (1:250, Abcam) и белку p53 (1:50, Abcam).
Нами были выбраны следующие маркерные биологически активные молекулы:
1) Белок Mif5 (Myogenic factor 5) – ключевой транскрипционный фактор регуляции миогенеза скелетных мышц. Принадлежит к семейству миогенных регуляторных факторов (MRFs), включающих в себя также белки MyoD(Myf3), миогенин, MRF4 (Myf6). Из всех транскрипционных факторов семейства MRFs Mif5 является самым ранним фактором дифференцировки и начинает экспрессироваться еще в эмбриогенезе. Mif5 индуцирует дифференцировку полипотентных миогенных клеток в направлении скелетных мышц [Kim A.R. et al., 2017].
2) Белок альфа-актинин-3 (ACTN3) стабилизирует сократительный аппарат скелетных мышц и участвует в большом количестве метаболических процессов. Альфа-актинин 3 сцепляет актиновые волокна в мышце и находится только в белых мышечных волокнах, повышая их сократимость и силу [Kathryn R Wagner, 2018].
3) Старение полипотентных клеток в культуре связано с увеличением активности гена p53. У мышей, имеющих мутацию в гене p53, отмечена повышенная устойчивость к развитию новообразований в сочетании с сокращением средней продолжительности жизни. Белок p53 играет ключевую роль в эндогенных противоопухолевых механизмах [Donekover et al., 2002]. Белок p53 осуществляет контроль над течением процессов клеточного цикла, а также за отсутствием в геноме повреждений, которые могли бы привести к дальнейшему развитию патологии. Белок р53 является транскрипционным фактором, выполняющим функцию супрессора образования злокачественных опухолей путем активации апоптоза в тканях организма. Белок р53 активируется при повреждениях ДНК, а также при стимулах, которые могут привести к подобным повреждениям или являются сигналом о старении клетки и нарушении ее функциональной активности [Arshad H. et al., 2010]. Р53-зависимый апоптоз позволяет избежать накопления мутаций, а, в случае, когда они уже возникли, p53-зависимый апоптоз позволяет элиминировать такие потенциально опасные для организма клетки [Burtis C., Ashwood E., Bruns D., 2006].
Материалы исследования
Для изучения свойств пептида IPH-AGAA нами были использованы следующие клеточные культуры Российской коллекции клеточных культур позвоночных (РККК П):
SC5
Происхождение: человек, эмбриональные стволовые клетки (ЭСК), бластоциста (5-6 день развития), полученные в результате ЭКО
Science. 1998. 282: 1145 – 1147; Онтогенез. 2011. 42 (4): 249 – 263;
Цитология. 2012. 54 (1): 5 – 16.
Морфология: колонии округлых клеток с высоким ядерно/цитопламатическим отношением.
Способ культивирования: монослойный; колонии прикреплены к митотически инактивированному (митомицин-С) фидерному слою мезенхимных клеток костного мозга эмбриона человека.
Условия культивирования: среда — Knockout Dulbecco’s modified Eagles medium сыворотка — Knockout Serum Replacement 20% др. компоненты – NEAA 1%, L-глютамин 2mM, 2- меркаптоэтанол 0.1 mM, bFGF — 8 нг/мл
процедура пересева – механический пересев культуры ЭСК проводили под контролем микроскопа путем разделения колонии на фрагменты с помощью одноразового скальпеля и переноса их на новый слой фидера; ежедневная смена среды, пересев каждые 5-6 дней.
криоконсервация — ростовая среда, 10% DMSO, 5х105 клеток/мл в ампуле.
Жизнеспособность после криоконсервации: 60 % (окраска трипановым синим на нулевом пассаже)
Контроль контаминации: бактерии, грибы и микоплазма не обнаружены.
Контроль видовой идентичности: кариологический анализ.
Кариология: 2n= 46, модальное число хромосом 46 (98.0+0.9 %), нормальный кариотип человека (46, XХ), количество полиплоидов (0.2 + 0.2%).
ДНК профиль (STR): Amelogenin: X, X
CSF1PO: 12, 13
D13S317: 8, 11
D16S539: 9, 12
D5S818: 9, 11
D7S820: 8,10,12
THO1: 6, 9.3
TPOX: 10, 11
vWA: 17,17
Другие характеристики:
Среднее время одного удвоения клеточной популяции 28.2 ч.
Линия иммортализованная, прошла более 120 удвоение клеточной популяции.
Экспрессия поверхностных антигенов, характерных для ЭСК человека: SSEA-4, TRA-1-60 и транскрипционных факторов Осt-4, Nanog.
Способность к спонтанной дифференцировке в производные 3-х зародышевых листков.
Способность к образованию in vivo тератом, содержащих производные 3-х зародышевых листков.
Область применения: клеточная биология, эмбриология.
Коллекции: Институт цитологии Российской академии наук (Рисунок 1) (Федеральное государственное бюджетное учреждение науки «Институт цитологии Российской академии наук, http://www.cytspb.rssi.ru/eotk/infbull_ru.htm, М.С. Богданова, Г.Г. Полянская, А.М. Кольцова «Клеточные культуры» Информационный бюллетень. Вып. 34 (2018),
http://www.cytspb.rssi.ru/rkkk/katalog1n_2017_with_figs.pdf).
Рисунок 1. Культура эмбриональные стволовые клетки SC 5. Световая микроскопия, х400.
Методы исследования
Группы для исследования:
1 группа – измерение экспрессии молекул до начала исследования,
2 группа — контроль (добавление питательной среды, инкубирование сывороточным альбумином),
3 группа – добавление контрольного пептида дипептида Glu-Trp в концентрации 100 микрограммов (мкг);
4 группа – добавление пептида IPH-AGAA в концентрации 100 микрограммов (мкг).
Для исследования использовали пептиды IPH-AGAA и Glu-Trp в форме лиофилизированного порошка, которые растворяли стерильной водой для инъекций в объёме 10 мл до конечной концентрации пептидов 100 мкг.
Для большинства диссоциированных клеточных культур, как было показано ранее, наиболее эффективной является концентрация пептидов 100 мкг/мл по многолетнему опыту применения пептидов [Линькова Н.С. и др., 2016; Khavinson V. et al., 2017].
В качестве контроля выбран иммунопротекторный пептид Glu-Trp с известными и хорошо описанными в литературе свойствами [Морозов В.Г., Хавинсон В.Х., Малинин В.В., 2000, Хавинсон В.Х., Морозов В.Г., 2001, Хавинсон В.Х., Кузник Б.И., Линькова Н.С., Проняева В.Е., 2013].
Для измерения уровня экспрессии генов применяли PCR-метод с использованием собственных праймеров и реагентов фирмы Novocasta и наборы моноклональных антител производства
фирмы Biosource (Бельгия).
Мазки клеток обрабатывались соответствующими первичными антителами по стандартному протоколу:
- Трехкратная промывка фосфатно-солевым буфером — ФСБ(рН=7,2) по 5 мин;
- Пермеабилизация клеток 0,1% Triton X-100, растворенном в ФСБ, в течение 15 мин;
- Промывка в трех сменах ФСБ (по 5 мин);
- Инкубация в 1% бычьем сывороточном альбумине (разведенным ФСБ, pH 7,5) в течение 30 мин для блокировки неспецифического связывания;
- Инкубация с первичными антителами, 60 мин;
- Промывка в трех сменах ФБС (по 5 мин);
- Инкубация со вторичными антителами, конъюгированными с флуорохромом Alexa Fluor 488 (1:1000, Abcam) 30 мин при комнатной температуре в темноте;
- Промывка в трех сменах ФСБ по 5мин;
- Докраска ядер клеток красителем Hoechst 33258 (Sigma, США) (1:100 от стокового раствора в dH2O) в течение 1 мин (краситель используется в качестве флуоресцентного маркера ДНК, при связывании с которой его флуоресценция усиливается).
- Промывка в ФСБ 5 мин;
- Заключение готовых препаратов под покровные стекла в монтирующую среду Dako Fluorescent Mounting Medium (Dako).
Изучение препаратов проводили в конфокальном микроскопе Olympus FluoView FV1000 при увеличении 200, 400, 600. Синим цветом флуоресцирует экспрессия исследуемого маркера. Проводили измерение относительной площади экспрессии в %. Относительную площадь экспрессии рассчитывали, как отношение площади, занимаемой иммунопозитивными клетками, к общей площади клеток в поле зрения и выражали в процентах. Динамика экспрессии генов измерена в условных единицах, базовый уровень принят за 10.
Статистическая обработка результатов
Статистическая обработка экспериментальных данных включала
в себя подсчет среднего арифметического, стандартного отклонения
и доверительного интервала для каждой выборки и проводилась
в программе Statistica 11.0. Если данные подчинялись нормальному распределению, различия в средних определялись с помощью критерия Стъюдента (t).
Влияние пептида IPH-AGAA на экспрессию генов, ответственных за формирование системы мышц человека
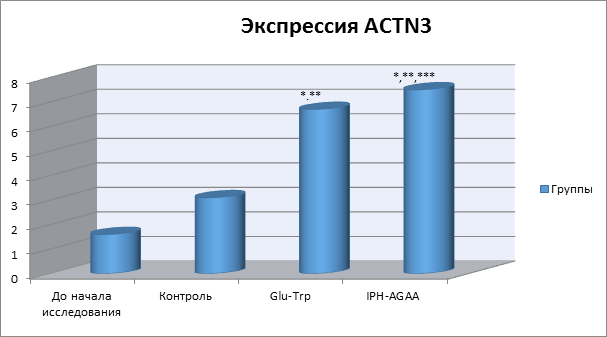
Так, на рисунке 2 нами показано, что пептид IPH-AGAA достоверно увеличивает экспрессию гена ACTN3, отвечающих за нормальное образование и формирование системы мышц, в частности, регулирующих метаболизм (обмена веществ) в мышечной ткани и уровень развития скоростно-силовых качеств у человека, что также позволяет оптимизировать обмен веществ в клетках мышечной ткани и оказывать антиоксидантное действие, при физических нагрузках препятствовать повреждению клеток мышечной ткани свободными радикалами.
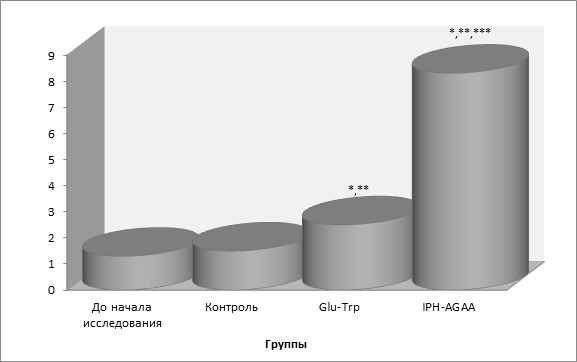
*p<0,05 по сравнению с исходными данными;
**p<0,05 по сравнению с контролем;
***p<0,05 между показателями уровня экспрессии при применении Glu-Trp и IPH-AGAA.
Рисунок 2. Экспрессия гена ACTN3, участвующего в формировании и регуляции системы мышц.
Так, на рисунке 3 нами показано, что пептид IPH-AGAA достоверно увеличивает экспрессию гена MSTN, контролирующего рост мышечной массы, в частности, гарантирующего отсутствие гипертрофированной мышечной ткани.
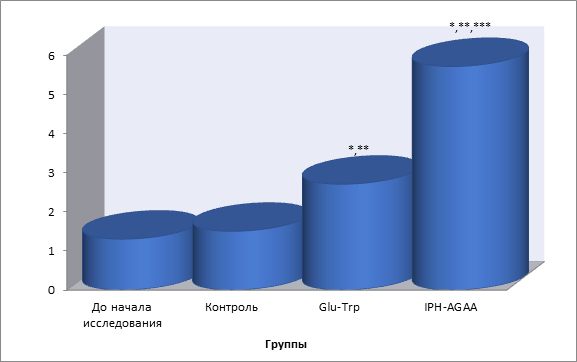
*p<0,05 по сравнению с исходными данными;
**p<0,05 по сравнению с контролем;
***p<0,05 между показателями уровня экспрессии при применении Glu-Trp и IPH-AGAA.
Рисунок 3. Экспрессия гена MSTN, контролирующего рост мышечной массы.
Таким образом, из приведенных данных видно, что под воздействием пептида IPH-AGAA в культуре клеток человека происходит статистически достоверное увеличение экспрессии генов, ответственных за онтогенез мышечной системы. Эти данные показывают, что пептид IPH-AGAA достоверно увеличивает в культуре клеток человека «каскад» сигнальных молекул, который необходим для активации процессов пролиферации и дифференцировки стволовых клеток в клетки мышечной системы, формирования системы мышц, регуляции метаболизма в мышечной ткани и определения тем самым уровня развития скоростно-силовых качеств у человека.
Влияние пептида IPH-AGAA на экспрессию белка Mif5 в культурах клетки человека
На рисунке 4 показано, что применение пептида IPH-AGAA повышает экспрессию Mif5 в 4 раза от исходного уровня, который является ключевым транскрипционным фактором регуляции миогенеза скелетных мышц.
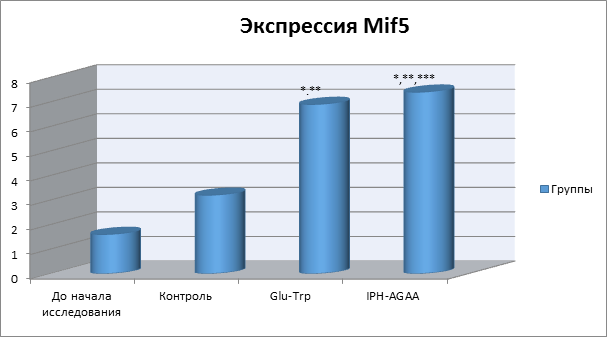
*p<0,05 по сравнению с исходными данными;
**p<0,05 по сравнению с контролем;
***p<0,05 между показателями уровня экспрессии при применении Glu-Trp и IPH-AGAA.
Рисунок 4. Влияние пептида IPH-AGAA на экспрессию Mif5 в культуре клеток человека.
Таким образом, применение пептида IPH-AGAA носит выраженный миопротекторный характер, в частности, индуцирует дифференцировку полипотентных миогенных клеток в направлении нормального формирования скелетных мышц и обеспечивает интенсивное и продолжительное питание клеток мышечной ткани.
Влияние пептида IPH-AGAA на экспрессию белка ACTN3 в культурах клетки человека
На рисунке 5 показано, что применение пептида IPH-AGAA значительно повышает экспрессию белка ACTN3 в 4,5 раза от исходного уровня, который стабилизирует сократительный аппарат скелетных мышц и участвует в большом количестве метаболических процессов, что приводит к оптимизации обмена веществ в клетках мышечной ткани, улучшению микроциркуляции в мышечной ткани и восстановлению водного и минерального баланса в мышцах.
*p<0,05 по сравнению с исходными данными;
**p<0,05 по сравнению с контролем;
***p<0,05 между показателями уровня экспрессии при применении Glu-Trp и IPH-AGAA.
Рисунок 5. Влияние пептида IPH-AGAA на экспрессию белка ACTN3 в культуре клеток человека.
Таким образом, применение пептида IPH-AGAA носит выраженный миопротекторный характер, в частности, повышая активность актиновых волокон в мышце, увеличивая сократимость и силу мышечной ткани, увеличивая тем самым эластичность и упругость мышц и оказывая стимулирующее действие на мышцы в условиях гипоксии.
Влияние пептида IPH-AGAA на экспрессию белка р53 в культурах клетки человека
На рисунке 6 показано, что применение пептида IPH-AGAA увеличивает выработку белка р53, который является транскрипционным фактором, выполняющим функцию супрессора образования злокачественных опухолей путем активации апоптоза в тканях организма, что позволяет сделать вывод о противоопухолевых свойствах изучаемого пептида.
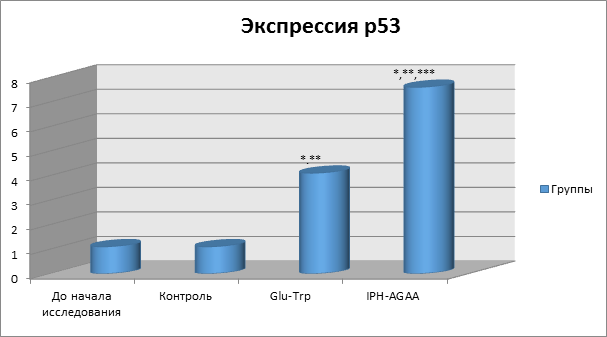
*p<0,05 по сравнению с исходными данными;
**p<0,05 по сравнению с контролем;
***p<0,05 между показателями уровня экспрессии при применении Glu-Trp и IPH-AGAA.
Рисунок 6. Влияние пептида IPH-AGAA на экспрессию белка p53 в культуре клеток человека.
Р53-зависимый апоптоз также позволяет избежать накопления мутаций, а, в случае, когда они уже возникли, p53-зависимый апоптоз позволяет элиминировать такие потенциально опасные для организма клетки, что позволяет сделать вывод о цитопротекторном действии изучаемого пептида.
Полученные данные свидетельствуют о высокой онкопротекторной активности пептида IPH-AGAA в отношении клеток системы мышц по данным экспрессии биологических молекул на культуре клетки.
ЗАКЛЮЧЕНИЕ
Выполненные исследования подтверждают высокую биологическую активность пептида IPH-AGAA в отношении контроля нормального формирования системы мышц у человека на генетическом уровне по данным экспрессии генов, ответственных за онтогенез мышечной системы. В частности, эти данные подтверждают, что применение пептида IPH-AGAA регулирует метаболизм (обмена веществ) в мышечной ткани и уровень развития скоростно-силовых качеств у человека, что также позволяет оптимизировать обмен веществ в клетках мышечной ткани и оказывать антиоксидантное действие, при физических нагрузках препятствовать повреждению клеток мышечной ткани свободными радикалами.
Пептид IPH-AGAA достоверно увеличивает в культуре клеток человека «каскад» сигнальных молекул, который необходим для активации процессов пролиферации и дифференцировки стволовых клеток в клетки мышечной системы, формирования системы мышц, регуляции метаболизма в мышечной ткани и определения тем самым уровня развития скоростно-силовых качеств у человека.
Применение пептида IPH-AGAA носит выраженный миопротекторный характер, в частности, индуцирует дифференцировку полипотентных миогенных клеток в направлении нормального формирования скелетных мышц и обеспечивает интенсивное и продолжительное питание клеток мышечной ткани. Применение пептида IPH-AGAA приводит к оптимизации обмена веществ в клетках мышечной ткани, улучшению микроциркуляции в мышечной ткани и восстановлению водного и минерального баланса в мышцах.
Применение пептида IPH-AGAA носит выраженный миопротекторный характер, в частности, повышая активность актиновых волокон в мышце, увеличивая сократимость и силу мышечной ткани, увеличивая тем самым эластичность и упругость мышц и оказывая стимулирующее действие на мышцы в условиях гипоксии.
Полученные данные свидетельствуют о высокой онкопротекторной активности пептида IPH-AGAA в отношении клеток системы мышц по данным экспрессии биологических молекул на культуре клетки.
Литература
- Линькова Н.С., Дробинцева А.О., Орлова О.А., Кузнецова Е.П., Полякова В.О., Кветной И.М., Хвинсон В.Х. Пептидная регуляция функций фибробластов кожи при их старении in vitro // Клеточные технологии в биологии и медицине. – 2016. — №1. – С. 40-44.
- Мутовин Г.Р.Основы клинической генетики (геномика и протеомика наследственной патологии). Учебное пособие для вузов в 2-х томах. Вып. 3. М.: ГЭОТАР-медиа, 2008.
- Хавинсон В.Х. Пептидная регуляция старения. СПб.: Наука, 2009. — 50 с.
- Ahmetov II, Druzhevskaya AM, Astratenkova IV, Popov DV, Vinogradova OL, Rogozkin VA. The ACTN3 R577X polymorphism in Russian endurance athletes. Br J Sports Med. 2010 Jul;44(9):649-52.
- Arshad H., Ahmad Z., Hasan S.H. Gliomas: correlation of histologic grade, Ki67 and p53 expression with patient survival // Asian Pac J Cancer Prev. – 2010. – Vol. 11. – N 6. – P. 1637-1640;
- Kathryn R Wagner, MD, PhD and Julie S Cohen, ScM, CGC. Myostatin-Related Muscle Hypertrophy// National Center for Biotechnology Information, U.S. National Library of Medicine- 2018.- № 4- 35-39.
- Kim A.R., Kim K.M., Byun M.R., Hwang J.H., Park J.I., Oh H.T., Kim H.K., Jeong M.G., Hwang E.S., Hong J.H. Catechins activate muscle stem cells by Myf5 induction and stimulate muscle regeneration // Biochem Biophys Res Commun. – 2017. – Vol. 489, N 2. – P. 142-148.
- Meienberg J, Rohrbach M, Neuenschwander S, Spanaus K, Giunta C, Alonso S, Arnold E, Henggeler C, Regenass S, Patrignani A, Azzarello-Burri S, Steiner B, Nygren AO, Carrel T, Steinmann B, Mátyás G. Hemizygous deletion of COL3A1, COL5A2, and MSTN causes a complex phenotype with aortic dissection: a lesson for and from true haploinsufficiency. Eur J Hum Genet. 2010;18:1315–21.




