В настоящее время большой интерес представляет изучение свойств пептидов [Dudgeon W.D. et al., 2016]. Пептиды имеют ту же структуру, что и белки (протеины), но размер этих молекул меньше. Важно также отметить, что короткие пептиды, являясь естественным продуктом обмена веществ, присутствующих в организме, не могут быть выявлены в крови или моче. В связи с этим интерес представляет изучение свойств отдельных структур на клеточных культурах.
Пептид IPH-AEN содержит низкомолекулярный пептид, обладает хондро- и остеопротекторными свойствами и оказывает нормализующее действие на хрящевую ткань и костную ткань. Экспериментальные исследования показали, что пептид IPH-AEN регулирует процессы метаболизма в хондроцитах и остеоцитах, повышает резервные возможности организма, что позволяет предполагать эффективность применения пептида IPH-AEN для нормализации функций и восстановления хрящевой и костной систем человека при нарушениях различного генеза.
В связи с этим целью нашего исследования было изучение хондро- и остеопротекторных и других свойств пептида.
Клиническая характеристика больных
Клинические испытания пептида IPH-AEN проведены у 88 людей с различными повреждениями коленного сустава в возрасте от 28 до 60 лет (средний возраст составил 39,7±1,2 года).
Критерии включения: пациенты с хондропатиями коленных суставов I-II степени, остеоартрозом коленных суставов 1-2 ст.
Критерии исключения: острые заболевания, пациенты с декомпенсированной патологией, пациенты имеющие обострение хронических заболеваний.
Для оценки эффективности дозы 100 мкг (n=88 человек) для изучаемых пептидов нами были проведены исследования по изучению эффективности применения пептидов в дозировке 50 мкг (n= 86 человек) и 150 мкг (n=87 человек). Доза 100 мкг в сутки для пептидов избрана в качестве используемой в связи с тем, что согласно исследованиям АННО ВО «Санкт-Петербургский институт биорегуляции и геронтологии» эффективная дозировка начинается со 100 мкг, а увеличение дозировки не влияет на степень эффективности [Хавинсон В.Х., Линькова Н.С., 2013].
Характеристика исследования
Пептид IPH-AEN применялся перорально по следующей схеме: по 1 капсуле (100 мкг пептида) 1 раз в день в течение 30 дней, затем 30 дней перерыв — и повторение аналогичного курса в течение еще 30 дней, снова перерыв 30 дней — и третий курс в течение 30 дней. Общий курс составил 6 месяцев (в нем 3 курса по 30 дней и 3 перерыва по 30 дней).
Оценка эффективности усовершенствованной схемы ведения таких пациентов с применением пептида IPH-AEN проводилась через 3 и 6 месяцев. За контрольные значения были выбраны исходные данные, полученные до начала исследования.
Эффективность применения пептида IPH-AEN оценивали на основании уровня кальмодулина в буккальном эпителии.
Получение образцов буккального эпителия из ротовой полости (слизистая оболочка щеки) осуществлялось не ранее чем через 4 часа после приема пищи с помощью стерильной цитощетки с синтетическим ворсом. После взятия соскоба, его путем стряхивания помещают в стерильную одноразовую пробирку «Эппендорф» с физиологическим раствором.
Цитологические мазки готовили методом жидкостной цитологии с использованием автоматизированной системы Novoprep (NRS, Франция).
Верификация экспрессии изученных сигнальных молекул связана с применением методов гибридизация in situ специфических матричных RNA (mRNA) и электронной микроскопии, с применением антител к активным молекулам. Образцы буккального помещали на покрытые поли-L-лизином предметные стекла (Sigma). Для иммуноцитохимического исследования использовались первичные и вторичные антитела — моноклональные мышиные анти-человеческие антитела к изучаемым сигнальным молекулам (Novocastra). Визуализацию иммуногистохимической реакции проводили с применением комплекса авидина с биотинилированной пероксидазой (ABC-kit), с последующим проявлением пероксидазы хрена диаминобензидином (Novocastra).
Методика визуализации экспрессии всех антител проводилась по следующей схеме.
- Для блокады эндогенной пероксидазы контейнер со стеклами помещали в 3% водный раствор перекиси на 10 минут.
- Промывка в 2 сменах дистиллированной воды по 5 минут в каждой.
- Промывка в 2 сменах трис-NaCl-буфера рН 7,6 по 5 минут в каждой.
- Инкубация с нормальной неиммунной сывороткой в течение 30 минут при комнатной температуре. Нанесение на стекло 50-100 мкл нормальной блокирующей сыворотки и помещение стекол во влажную камеру.
- Инкубация в термостате с первичными (специфичными) антителами (+37°C, 1 час).
- Промывка в 2 сменах трис-NaCl-буфера рН 7,6 по 5 минут в каждой.
- Инкубация со вторичными биотинилированными антителами в течение 30 минут при комнатной температуре.
- Промывка в 2 сменах трис-NaCl-буфера рН 7,6 по 5 минут в каждой.
- Инкубация с АВС-kit 30 минут при комнатной температуре.
- Промывка в 2 сменах трис-NaCl-буфера рН 7,6 по 5 минут в каждой.
- Выявление пероксидазы хрена диаминобензидином (раствор готовили по инструкции, прилагающейся к набору Novocastra). Проявление реакции контролировали под микроскопом.
- Промывка в 2-х сменах дистиллированной воды по 5 минут в каждой.
- Промывка водой.
- Дегидратация — экспозиция по 3 минуты в каждом из следующих растворов: спирт 96%, спирт 96%, карбоксилол, ксилол, ксилол.
- Визуализация с помощью конфокального микроскопа Olympus FluoView FV1000 при увеличении 400.
Кальмодулин — небольшой, кислый, высококонсервативный кальций-связывающий белок, представитель суперсемейства белков EF-hand.
Кальмодулин обнаружен в цитоплазме всех эукариотических клеток, что отличает его от других кальций-связывающих белков. Молекула белка состоит из двух глобулярных долей (доменов), разделённых центральным спиральным шарниром. Каждая глобулярная доля имеет по два Ca2+-связывающих сайта, содержащих мотив спираль-петля-спираль (EF-hand). Сам кальмодулин не проявляет ферментативной активности, но является интегральной субъединицей целого ряда ферментов (протеинкиназы, протеинфосфатазы, фосфодиэстеразы, ферменты мышечной подвижности). Он связывает и активирует более 40 мишеней. Концентрация кальмодулина в клетке варьирует в пределах 5-10 мкМ и составляет около половины концентрации всех СаМ-связывающих белков.
Снижение данного белка обнаруживается при повреждении хрящевой ткани и приводит к ухудшению регенерации и репарации.
Норма уровня кальмодулина (Anti- CalEF-hand antibody) в буккальном эпителии (25-60 лет): 7,8 – 14,6 условных единиц (у.е.).
Эффективность применения пептида IPH-AEN также оценивали на основании субъективных ощущений (с помощью ВАШ – визуальной аналоговой шкалы) и проводили оценку состояния гиалинового хряща коленных суставов методом ультрасонографии на аппарате Samsung SonoAce R3 с использованием высокочастотного линейного датчика с частотой 7,5- 10,0 МГц. Оценивали структуру и толщину гиалинового хряща мыщелков бедренной кости травмированного коленного сустава с вычислением индекса дегенеративного истончения хряща (ИДИХ) путем отношения толщины гиалинового хряща нагружаемой поверхности к толщине хряща задней поверхности мыщелка бедренной кости. Степень структурных изменений хряща оценивали по классификации ICRS (International Repair Society), модифицированной для ультразвуковой диагностики, согласно которой выделяли 4 степени дегенеративных изменений хряща: 0 (нормальный хрящ), 1 степень (повышение эхогенности, умеренно неровный контур, обычная толщина), 2 степень (повышение эхогенности, неоднородная структура, неровный контур, уменьшение толщины хряща до 50%, ИДИХ 0,5-0,8), 3 степень (повышение эхогенности, неоднородная структура, выраженно неровный контур с эрозированными зонами, истончение хряща более 50%, ИДИХ менее 0,5), 4 степень (обширные зоны отсутствия хрящевой ткани на суставной поверхности).
Статистическая обработка данных и результаты исследования
Статистический анализ осуществлялся с помощью программы STATISTICA 11. В основе статистических методов обработки данных был проведен расчет средних абсолютных и относительных величин с расчетом ошибки средней; выполнена оценка значимости различий двух совокупностей с применением критерия t Стьюдента (разность показателей считалась достоверной при t>2, р<0,05).
Результаты клинического изучения применения пептида IPH-AEN показали, что у пациентов через 3 месяца после применения данного пептида достоверно улучшается субъективная оценка боли в 1,4 раза (Таблица 1).
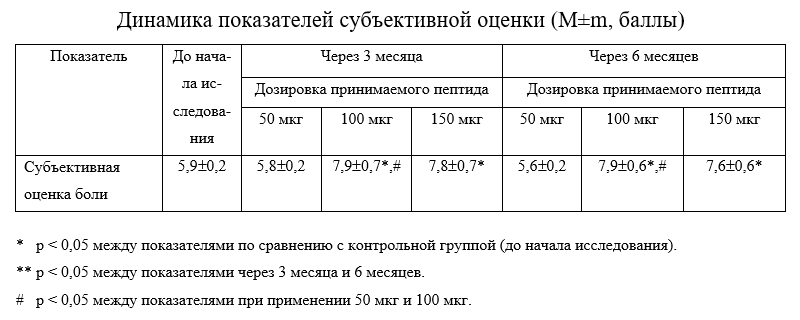
Это подтверждает тот факт, что применение пептида IPH-AEN приводит к снижению воспалительной реакции и тем самым к снижению болевых ощущений, отмечаемых у пациентов с дегенеративно- дистрофическими повреждениями костно- хрящевой ткани.
Нами не обнаружено достоверных отличий между показателями при применении 100 мкг и 150 мкг по всем исследуемым параметрам, что доказывает факт, что при повышении оптимальной дозировки применяемого пептида эффективность не повышается как через 3 месяца, так и через 6 месяцев.
Также нами не обнаружено достоверных отличий между показателями при применении 50 мкг и до начала исследования по всем исследуемым параметрам, что доказывает факт, что эффективная оптимальная дозировка для пептида 100 мкг.
Применение пептида IPH-AEN увеличивает экспрессию молекулярного маркера кальмодулина до верхней границы нормы. В то самое время как в начале исследования уровень кальмодулина был снижен в связи с наличием дегенеративного поражения хряща у исследуемых пациентов (Таблица 2).

Таким образом, нами было выявлено, что применение пептида IPH-AEN способствует достоверному улучшению регенерации и репарации костно- хрящевой ткани при дегенеративно – дистрофических поражениях костно- хрящевой ткани, а также оказывает противодействие дегенеративным процессам в хрящевой ткани суставов, тем самым обеспечивая профилактику заболеваний суставов.
Нами не обнаружено достоверных отличий между показателями при применении 100 мкг и 150 мкг по всем исследуемым параметрам, что доказывает факт, что при повышении оптимальной дозировки применяемого пептида эффективность не повышается как через 3 месяца, так и через 6 месяцев.
Также нами не обнаружено достоверных отличий между показателями при применении 50 мкг и до начала исследования по всем исследуемым параметрам, что доказывает факт, что эффективная оптимальная дозировка для пептида 100 мкг.
Динамика индекса дегенеративного истончения хряща приведена в таблице 3.
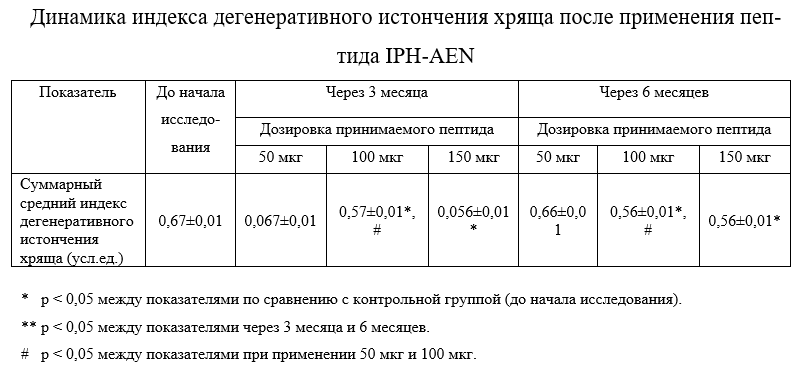
Применение пептида IPH-AEN приводило к положительной динамике показателей ультразвукового исследования: снизилась эхогенность и стали более четкими контуры суставного хряща, снизился показатель дегенеративного истончения хряща в 0,9 раз. Эти данные свидетельствует о том, что применение пептида IPH-AEN приводит к нормализации структуры и толщины хрящевой поверхности при дегенеративно – дистрофических поражениях костно- хрящевой ткани, что необходимо для поддержания полноценной функциональности суставов.
Нами не обнаружено достоверных отличий между показателями при применении 100 мкг и 150 мкг по всем исследуемым параметрам, что доказывает факт, что при повышении оптимальной дозировки применяемого пептида эффективность не повышается как через 3 месяца, так и через 6 месяцев.
Также нами не обнаружено достоверных отличий между показателями при применении 50 мкг и до начала исследования по всем исследуемым параметрам, что доказывает факт, что эффективная оптимальная дозировка для пептида 100 мкг.
Заключение
Таким образом, применение пептида IPH-AEN приводит к снижению воспалительной реакции и тем самым к снижению болевых ощущений, отмечаемых у пациентов с дегенеративно- дистрофическими повреждениями хрящевой ткани.
Применение пептида IPH-AEN способствует достоверному улучшению регенерации и репарации костно- хрящевой ткани при дегенеративно – дистрофических поражениях костно- хрящевой ткани, а также оказывает противодействие дегенеративным процессам в хрящевой ткани суставов, тем самым обеспечивая профилактику заболеваний суставов.
Применение пептида IPH-AEN приводит к нормализации структуры и толщины хрящевой поверхности при дегенеративно – дистрофических поражениях костно- хрящевой ткани, что необходимо для поддержания полноценной функциональности суставов.
Применение пептида IPH-AEN рекомендовано в виде биологически активной добавки к пище с лечебно-профилактической целью для нормализации функций костно- хрящевой ткани.
Литература
- Забелло Т.В., Мироманов А.М., Мироманова Н.А. Генетические аспекты развития остеоартроза // Фундаментальные исследования. – 2015. – № 1-9. – С. 1970-1976
- Линькова Н.С., Дробинцева А.О., Орлова О.А., Кузнецова Е.П., Полякова В.О., Кветной И.М., Хвинсон В.Х. Пептидная регуляция функций фибробластов кожи при их старении in vitro // Клеточные технологии в биологии и медицине. – 2016. — №1. – С. 40-44.
- Пальцева Е. М., Полякова В. О., Крулевский В. А. Буккальный эпителий. Новые подходы к молекулярной диагностике социально-значимой патологии. Спб.: Издательство: «Н-Л», 2015. 128 с. ISBN: 978-5-94869-176-3
- Хавинсон В.Х. Пептидная регуляция старения. СПб.: Наука, 2009. — 50 с.
- Trzeciak T. MicroRNAs: Important Epigenetic Regulators in Osteoarthritis / T. Trzeciak, M. Czarny-Ratajczak // Curr. Genomics. – 2014. – № 6. – P. 481–484.
- Tsezou A. Osteoarthritis year in review 2014: genetics and genomics // Osteoarthritis Cartilage. – 2014. – № 12. – P. 2017–2024.




