Введение
Растения являются чрезвычайно богатым источником пептидов с потенциалом для разработки в качестве противоопухолевых агентов, например, семейства фиалковые, мареновые и тыквенные, а также некоторые морские растения. С открытием все большего количества пептидов с противоопухолевой активностью, их механизмы действия на опухоли также варьируют, как будет рассмотрено ниже. В этом обзоре кратко обсуждаются недавние исследования пептидов из растительных источников, включая наземные и морские растения, с акцентом на их происхождении, противоопухолевую активность и возможные механизмы действия, чтобы подготовить профиль важных растительных пептидов.
Пептиды, группа соединений, состоящая из двух или более аминокислот, связанных пептидной связью, и в изобилии присутствующая в живых организмах. Тысячи пептидов были выделены из животных, растений и микроорганизмов. Основываясь на их химической структуре, пептиды можно разделить на линейные и циклические пептиды. Исследования показали, что большинство пептидов, выделенных из растений, являются циклическими пептидами, так называемыми циклопептидами. По сравнению с линейными пептидами циклопептиды проявляют более мощную биологическую активность, возможно, благодаря стабильной конфигурации, обеспечиваемой их циклической структурой. Фармакологические исследования доказали, что многие пептиды, в том числе выделенные из растений, обладают потенциальным противоопухолевым действием. Эти пептиды имеют ряд преимуществ перед другими химическими агентами, включая их низкую молекулярную массу, относительно простую структуру, более низкую антигенность и меньшее количество побочных действий, легкую абсорбцию и различные пути введения.
Растения являются огромным ресурсом для организмов, обитающих на земле. В последние годы одним из наиболее активных направлений исследований является поиск природных компонентов растений с мощной противоопухолевой активностью и низкой токсичностью. Однако, исследования пептидов из растений, особенно в отношении их противоопухолевой активности, не продвинулись так быстро, как в случае других соединений. Поэтому стоит подчеркнуть важность и потенциальное будущее исследований с участием противоопухолевых пептидов из растительных источников.
Растительные источники пептидов
Наземные растения
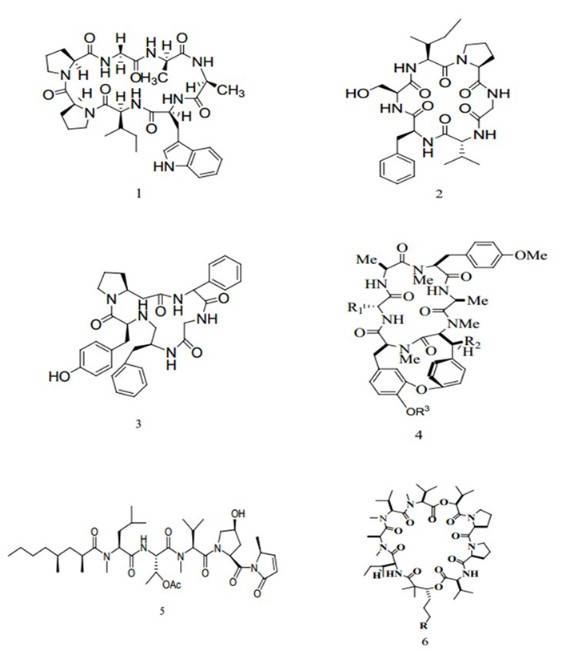
Циклопептиды из наземных растений можно разделить на два типа. Одним из них являются нормальные циклопептиды, которые обычно состоят из менее чем 14 аминокислотных остатков без дисульфидной связи. Как правило, эти пептиды являются вторыми метаболитами растений, и около 455 циклопептидов были обнаружены у высших растений, принадлежащих к 26 семействам, 65 родам и 120 видам. В частности, растения семейств гвоздичных и крушиновых обычно содержат циклопептиды[1].
Так было зарегистрировано, что некоторые циклопептиды имеют мощную противоопухолевую активность, например, черимойя циклопептид С(1)[2], циклогептапептид из семян Черимойя (семейство Анновые) Annona cherimola; гвоздика Е(2), циклический гексапептид в гвоздике пышной; longicalycinin а(3)[4], циклический гептапептид в гвоздике пышной Dianthus Superbus longicalycinus; RA-XVII(4), бициклический гексапептид в мареновых (Rubiaceous) растениях[5] и остеоспермумных (astis) [6], семейство циклопентапептидов, выделенных из корней лекарственного растения астра татарская (Aster tataricus). Другой тип циклопептида включает недавно открытые циклотиды. Циклотиды представляют собой большое семейство минпротеинов, состоящее из 28-37 аминокислотных остатков с дисульфидными связями, которые имеют четко выраженные вторичные структуры и принимают компактную трехмерную складчатую структуру так же, как и крупные белки[7]. Циклотиды исключительно стабильны и устойчивы к денатурации при термической, химической или ферментативной обработке. До сих пор они были найдены только в растениях мареновых, фиалковых и тыквенных, а фиалковые уникальны тем, что циклотиды присутствуют во всех видах этого семейства, исследованных до сих пор, и особенно распространены в роде Виола (Viola). Сообщалось, что в лабораторных условиях цикло-GESCVWIPCITSAIGCSCKSKVCYRNGIPC, выделенный из фиалки трехцветной, вариация А, (цикло- GETCVGGTCNTPGCSCSWPVCTRNGLPVC) и вариация F (цикло – TCTLGTCYTAGCSCSWPVCTRNGVPICGE) из фиалки полевой, и цикловиолацин O2[10] из фиалки душистой имеют противоопухолевые действия. В добавлении, некоторые линейные пептиды, как PSPP3[11], тридекапептид внутри пыльцы мака снотворного (Papaver somniferum) и RPPI, и додекапептид в пыльце китайского рапса[12], и цитотоксический пептид (KSCCKNTTGRNIYNTCRFAGGSRERCAKIJSGCKIIS ASTCPSDYPK) в омеле окрашенной (Viscum coloratum)[13] также имеют потенциал к противоопухолевой активности.
Морские растения
Из-за сложных условий, морские растения развили множество сложных механизмов, позволяющих им выживать и противостоять инфекциям. Поэтому они имеют большой потенциал в качестве противоопухолевых агентов. Исследования показали, что 3,5% экстрактов морских растений проявляют цитотоксическое или противоопухолевое действие [14]. Противоопухолевые пептиды морских растений обычно стабильны и обладают превосходной биодоступностью, что обусловлено наличием в их структуре D-аминокислот, гидроксильной кислоты, ряда новых а — и b — аминокислот, а также тиофена и оксазола [15]. Морские водоросли являются основным источником пептидов в морских растениях. Многие противоопухолевые пептиды были выделены из сине-зеленых водорослей (Cyanophyta), бурых водорослей (Phaeophyta) и красных водорослей (Rhodophyta), например, и микроколин А(5) [16], линейный пептид из сине-зеленых водорослей; криптофицины[17], класс циклических депсипептидов, включая 25 аналогов, были выделены из носток, род цианобактерии (Nostoc sp. GSV 224 cyanobacterium). Некоторые высоко цитотоксические пептиды были также выделены из лингбии, род цианобактерии (cyanobacterium lyngbya majuscule), Гомодоластатина (Homodolastatin) 16[18]; лингбия семиплена (L. Semiplena), вевакпептины (6)[19] и из комковатой симплоки (Symploca hydnoide), малеимид D[20].
Противоопухолевая активность и механизмы действия пептидов
Исследования показали, что пептиды из растений проявляют заметное ингибирующее действие на пролиферацию различных опухолевых клеточных линий, таких как мышиный лейкоз, остеобластоподобная саркома у крыс, карцинома носоглотки человека, рак легких, печени и молочной железы и опухоль яичников. Се и соавторы (Hsieh и другие) [3] выделили 4 циклопептида из гвоздики пышной, диантусов C, D, E и F и обнаружили, что диантин E значительно тормозит рост линии клеток рака печени человека HepG2 с IC50 2,37 мг/мл в искусственных условиях. Сообщалось, что лонгикалицинин А активен против линий раковых клеток HepG2 с IC50 13,52 мг/ мл[4]. Семнадцать соединений, RА-I-XVI и RА-dimer-A, были вычленены от марены красильной (Rubia akane Nakai) или марена сердцелистная (Rubia cordifolia), и два соединения, бувардия (NSC 259968) и деоксибувардия (RA-V), из другого маренового растения, бувардия тернифолия (Bouvardia ternifolia). Эти циклопептидные типы пептидов обладают многообещающей противоопухолевой активностью. (табл. 1), и RA-VII (1) прошла I фазу клинических испытаний в качестве противоопухолевого препарата в Японии[5]. Вискотоксин В2, линейный пептид из стебля и листьев омелы окрашенной (Viscum coloratum), как сообщается, имеет IC50 1,6 мг/мл в искусственных условиях на Остеобластоподобных клетках саркомы у крыс 17/2,8 клетки[11]. Циклопептид С оказывает значительное снижающее действие на клетки KB с IC50 в 0,072 Амоль/Л[2]. В лабораторных условиях имеет IC50 0,6 / Амоль/л и 1 моль/л в клетках лимфомы человека (U937GTB) и миеломы (RPMI-8226/s) соответственно[8]. Varv A, varv F и цикловиолацин O2 проявляют сильную цитотоксическую активность. Цикловиолацин O2 является наиболее мощным против всех клеточных линий (IC50 0,1-0,3 м.моль), за ним следуют varv a (IC50 2,7-6,35 м.моль) и varv F (IC50 2,6 -7,4 м.моль), соответственно[10]. Пыльца не только богата питательными веществами, но также содержит много активных ингредиентов с терапевтическим потенциалом. Ксю и соавторы (Xu JX) [11] вычленили пептиды из пыльцы мака снотворного (Papaver somniferum) и обнаружили, что тридекапептид обладает значительным снижающим эффектом в линии клеток рака печени человека Bel-7402 и линии клеток рака молочной железы MCF7.
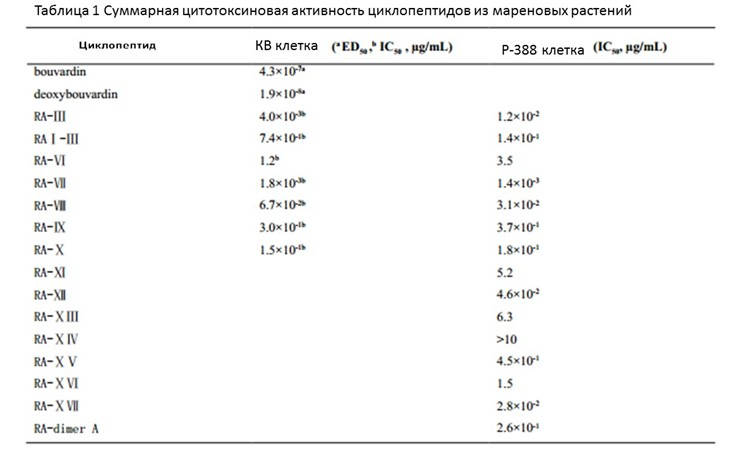
Некоторые пептиды из морских растений также проявляют потенциальную противоопухолевую активность. Установлено, что два циклопептида из лингбии семиплена (lyngbya semiplena) обладают значительными цитотоксическими эффектами в клеточной линии NCI-H460 опухоли легкого человека и нейробластомы у мышей neuro-2a, и IC50 для обеих опухолевых клеток составляет 0,4 м.моль/л[19]. Малевамид D обладает высокой цитотоксичностью, со значениями IC50 0,3-0,7 нг (0,2-0,5 нг/мл) против клеточных линий Р-388 (лимфома мыши), А-549 (карцинома легкого человека) и НТ-29 (карцинома толстой кишки человека) и 0,7 Нм против клеточной линии MEL-28 (меланома человека) [20]. Джамайкамид А, липопептид из лингбии (lyngbya majuscula), имеет IC50 15 м.моль / л в искусственных условиях против человеческого рака легких H460 и нейробластомных клеточных линий нейробластомы мыши neuro-2a[21]. Лингбибелинс (Lyngbyabellins) представляет собой группу циклических депсидпептидов, выделенных из лингбии, которые обладают цитотоксической и противогрибковой активностью, причем Lyngbuabellin D имеет IC50 0,1 м.моль/л в клетках KB[22]. Кахалалид О (Kahalalide) — циклопептид из молюска украшенная элизия (sacoglossan Elysia ornata) и его водорослевой диеты – водорослей семейства бриопсидовые (Bryopsis sp.)- оказывает значительное ингибирующее действие на клетки Р-388 и клетки рака легкого человека А549[23]. Как упоминалось ранее, механизмы противоопухолевого действия этих пептидов также сложны и включают вмешательство в полимеризацию и деполимеризацию микротрубочек, индуцирование апоптоза клеток, изменение клеточного цикла, ингибирование ангиогенеза против множественной лекарственной устойчивости и прерывание трансдукции сигнала.
Прерывание микротрубочковой активности клеток
Микротрубочки, главный компонент цитоскелета, играют несколько важных ролей, включая поддерживание клеточной формы, пролиферацию. движение, и нейротрансмиссию. Конденсация и диссоциация клеточных микротрубочек являются важными процессами пролиферации клеток. Прерывание таких процессов может остановить деление во время митоза клетки, что приводит либо к продлению клеточного цикла, либо к апоптозу клетки. Криптофицины представляют собой группу пептидов, которые были выделены из видов носток (Nostoc). Исследования в лабораторных условиях показали, что криптофицин-1, наиболее эффективное соединение в этой группе, оказывает ингибирующее действие на множественные линии опухолевых клеток[16]. Недавно было сообщено, что криптофицин 52 также оказывает ингибирующее действие на опухолевые клетки человека[24]. Дальнейшие исследования показали, что механизм противоопухолевого действия криптофицинов включает индукцию диссоциации микротрубочек и блокирование G2/M фазы клеточного цикла[25]. Скитофицин В (Scytophycin В), макроциклолид пептид, выделенный из морских сцитоенем (Scytonema pseudohofmanni), является эффективной диссоциации вызывающие микротрубочки соединения. Он обладает мощным ингибирующим действием на клетки Льюиса рака легких, клетки мышиного лейкоза P388 и клетки KB человека в лабораторных условиях [26].
Индукция апоптоза клеток
В настоящее время принято считать, что генез опухолей является результатом не только потери контроля над пролиферацией клеток и аномальной дифференцировкой клеток, но и дисбаланса в апоптозе опухолевых клеток. Поэтому новая стратегия терапии рака заключается в индуцировании апоптоза опухолевых клеток. Коццолино и соавторы (Cozzolino et al. [6]) продемонстрировал, что асти, группа циклопептидов из татарской астры (Aster tataricus), проявляет значительную активность в лаюораторных условиях на клетках KB и на мышиной саркоме 180 асцитах и лимфоцитарном лейкозе p388 у мышей. Эти соединения могут индуцировать апоптоз опухолевых клеток NPA человека путем активации каспазной активности[6]. Жанг и соавторы (Zhang et al.) сообщали, что микроколин А, линейный пептид, выделенный из лингбии (lyngbya majuscula), может ингибировать клеточную пролиферацию и иммунитет, возможно, через индукцию апоптоза клеток, предполагая, что это соединение потенциально может быть активным против опухолевых клеток[16].
Блокада клеточного цикла
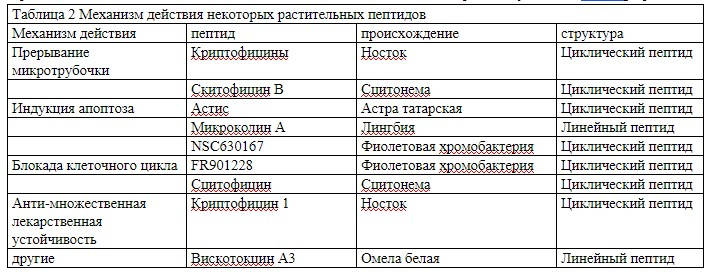
Клеточный цикл представляет собой упорядоченный набор событий, кульминацией которых является рост и деление клеток на дочерние клетки, а активными фазами клеточного цикла являются G1, S, G2 и митоз. Депсипептид (FR901228, NSC 630176) является новым противоопухолевым агентом, выделенным из ферментационноой жидкой среды фиолетовой хромбактерии (chromobacterium violaceum). NSC630167 является ингибитором гистондеацетилазы, выделенной из фиолетовой хромбактерии (Chromobacterium violaceum), и этот циклопептид может привести в клеточном цикле к задержке G0/G1 фазы за счет снижения экспрессии онкогена c-myc mRNA в некоторых опухолевых клетках. Исследования показали, что NSC630167 оказывает значительное влияние на различные линии клеток твердых опухолей человека в лабораторныъх условиях [27-28].
FR901228 обладает противоопухолевой активностью не только селективно индуцируя апоптоз опухолевых клеток, но и индуцируя остановку фазы G0/G1 опухолевых клеток[29].
Анти-множественная лекарственная устойчивость
Лекарственная устойчивость опухолевых клеток является одной из важных причин неудач химиотерапии. Поэтому одной из стратегий поиска противоопухолевых препаратов является выявление ингибиторов множественной лекарственной устойчивости. Основным механизмом развития лекарственной устойчивости опухолей является высокая экспрессия гена множественной лекарственной устойчивости, кодируемого Р-гликопротеином. P-гликопротеин является энергозависимым лекарственно-элиминирующим насосом, который обладает сложными мембранными транспортными функциями. Когда Р-гликопротеин связывается с лекарственным средством в клетке, лекарственное средство может быть закачано во внеклеточное пространство путем изменения его конфигурации или других механизмов, тем самым уменьшая внутриклеточные концентрации лекарственного средства для снижения токсичности лекарственного средства для клетки. Скитофицины, как упоминалось ранее, являются не только индуктором диссоциации микротрубочек, но и синижают экспрессию Р-гликопротеина[30]. Кроме того, криптофицин 1 оказывает значительное влияние на различные клетки, в том числе клетки, проявляющие множественную лекарственную устойчивость. Из-за их хорошей растворимости в воде и потенциальной эффективности криптофицины являются потенциальными кандидатами для будущих клинических исследований [17, 31].
Другие
Вискотоксины можно выделить из омелы белой (Viscum album), и они показали значительную цитотоксичность во многих линиях опухолевой клетки. Кулон с соавторами (Coulon et al.)[32] сообщают, что вискотоксин А3, линейный пептид, проявляет противоопухолевую активность, возможную за счет уменьшения стаза клеточной мембраны.
Заключение
Таким образом, растения являются чрезвычайно богатым источником пептидов с потенциальными противоопухолевыми свойствами. Как обсуждалось выше, пептиды, полученные из различных растений, как в наземных, так и в морских средах, имеют различные химические структуры с различными характеристиками и фармакологическим действием. Более интересно, что эти пептиды также имеют сложные механизмы действия в отношении опухолей (Таблица 2). До настоящего времени изучено лишь несколько растительных пептидов с точки зрения механизмов их противоопухолевого действия. Поэтому предстоит пройти долгий путь в поисках большего количества растительных пептидов с противоопухолевой активностью и выявления механизмов действия этих пептидов с учетом их потенциальной терапевтической полезности в онкологии. Считается, что после детальных и всесторонних исследований будет обнаружено больше пептидов с противоопухолевой активностью, и некоторые из них могут стать лекарственными средствами, которые используются клинически в качестве противоопухолевой химиотерапии.
Список литературы
[1] Tan NH and Zhou J. Plant Cyclopeptides. Chem Rev, 2006, 106: 840-895.
Wele A, Zhang Y, Ndoye I, et al. A cytotoxic cyclic heptapeptide
from the seeds of Annona cherimola. J Nat Prod, 2004, 67: 1577-1579.
Hsieh P, Chang F, Wu C, et al. New cytotoxic cyclic peptide and
dianthramide from Dianthus superbus. J Nat Prod, 2004, 67: 1522-1527.
Hsieh P, Chang F, Wu C, et al. LongicalycininA, a new cytotoxic
cyclic peptide from Dianthus superbus var. longicalycinus (Maxim.) Will. Chem Pharm Bull, 2005, 53(3): 336-338.
Hitotsuyanagi Y, Ishikawa H, Hasuda T, et al. Isolation, structural elucidation, and synthesis of RA-XW, a novel bicyclic hexapetide from Rubia cordifolia, and the effect of side chain at residue 1 upon the conformation and cytotoxic activity. Tetrahedron Letters, 2004, 45: 935-938.
Cozzolino R, Palladino P, Rossi F, et al. Antineoplastic cyclic
astin analogues kill tumour cells via caspase-mediated induction of apoptosis. Carcinogenesis, 2005, 26: 733-739.
Craik DJ, Daly NL, Mulvenna J, et al. Discovery, Structure and
Biological Activities of the Cyclotides. Current Protein and Peptide Science, 2004, 5: 297-315.
Svangard E, Goransson U, Hocaoglu Z, et al. Cytotoxic cyclotides from Viola tricolor. J Nat Prod, 2004, 67: 144-147.
Goransson U, Luijendijk T, Johansson S, et al. Seven novel macrocyclic polypeptides from Viola arvensis. J Nat Prod, 1999, 62: 283-286.
Lindholm P, Goransson U, Johansson S, et al. Cyclotides: A Novel Type of Cytotoxic Agents. Molecular Cancer Therapeutics, 2002, 1:365-369.
Xu JX, Jin S. Studies on synthesis, structure and antitumor avtivities of analogues of Papaver Somniferum pollen tridecapepide. Chemical Journal of Chinese Universities, 1999, 20: 722-726.
Wan KK, Song YL, Ji AX, et al. Synthesis and Studies on Properties of Water Soluble Chinese Rape Pollen Dodecapeptide. Chemical Journal of Chinese Universities, 1995, 16: 543-548.
Kong JL, Du XB, Fan CX, et al. Determination of primary structure of a novel peptide from mistletoe and its antitumor activity. Acta Pharmaceutica Sinica, 2004, 39: 813-817.
Wu WT, Wang YT, Wu WJ. Advances of Several Study on Marine Active Substance. Pharmaceutical Biotechnology (in Chinese), 2000, 7: 179-183.
Yu RM, Yan CY, Qu HY, et al. Progress and perspective of studies on the bioactive polypeptide from marine products. Marine Science Bulletin (in Chinese), 2004, 23: 88-93.
Zhang LH, Longley RE. Induction of apoptosis in moude thymocytes by microcolin A and its synthetic analog. Life Science (in Chinese), 1999, 64: 1013-1028.
Chaganty S, Golakoti T, Heltzel C, Moore RE, et al. Isolation and Structure Determination of Cryptophycins 38, 326, and 327 from the Terrestrial Cyanobacterium Nostoc sp. GSV 224. J Nat Prod, 2004, 67: 1403-1406.
Davies-Coleman MT, Dzeha TM, Gray CA, et al. Isolation of Homodolastatin 16, a new cyclic depsipeptide from a Kenyan collection of Lyngbya majuscule. J Nat Prod, 2003, 66: 712-715.
Han B, Goeger D, Maier CS, et al. The Wewakpeptins, cyclic depsipeptides from a Papua New Guinea collection of the marine cyanobacterium Lyngbya semiplena. Org Chem, 2005, 70: 3133-3139.
Horgen FD, Kazmierski EB, Westenburg HE, et al. Malevamide D; Isolation and structure determination of an Isodolastatin H analogue from the marine cyanobacterium Symploca hydnoides. J Nat Prod, 2002, 65: 487-491.
Edwards DJ, Marquez BL, Nogle LM, et al. Structure and Biosynthesis of Jamaicamides, New Mixed Polyketide-Peptide Neurotoxins from the Marine Cyanobacterium Lyngbya majuscule. Chemistry & Biology, 2004, 11: 817-833.
Williams PG, Luesch H, Yoshida WY, et al. Continuing studies on the cyanobacterium Lyngbya sp.: isolation and structure determination of 15-norlyngbyapeptinA and lyngbyabellinD. J Nat Prod, 2003, 66 (5): 595-598.
Horgen FD, delos Santos DB, Goetz G, et al. A new depsipeptide from the sacoglossan mollusk Elysia ornata and the green alga Bryopsis species. J Nat Prod, 2000, 63: 152-154.
Al-Awar RS, Corbett TH, Ray JE, et al. Biological evaluation of cryptophycin52 fragment A analogues: effect of the multidrug resistance ATP binding cassette transporters on antitumor activity. Molecular cancer therapeutics, 2004, 3: 10612-10617.
Trimurtulu G, Ohtani I, Patterson G, et al. Total structures of cryptophycins, potent antitumor depsipeptides from the blue- green alga Nostoc sp. Strain GSV 224. Am Chem Soc, 1994, 116(11): 4729-4737.
Smith CD, Carmeli S, Moore RE, et al. Scytophycins, novel microfilament-depolymerizing agents which circumvent P-glycoprotein-mediated multidrug resistance. Cancer Res, 1993, 53: 1343-1347.
Sandor V, Bakke S, Robey RW, et al. Phase I Trial of the Histone Deacetylase Inhibitor, Depsipeptide (FR901228, NSC 630176), in Patients with Refractory Neoplasms. Clinical Cancer Research, 2002, 8: 718-728.
Schwartsmann G, Brondani da Rocha A. Berlinck RG, et al. Marine organisms as a source of new anticancer agents. Lancet Oncol, 2001, 2: 221-225.
Song P, Wei J, Wang H.-CR. Distinct roles of the ERK pathway in modulating apoptosis of Ras-transformed and nontransformed cells induced by anticancer agent FR901228. FEBS Letters, 2005, 579: 90-94.
Yadav JS, Ahmed MM. A stereoconvergent synthesis of the C(19)-C(13) fragment of scytophycin C. Tetrahedron Letters, 2002, 43: 7147-7150.
Panda D, Himes RH, Moore R, et al. Mechanism of action of the unusually potent microtubule inhibitor cryptophycin1. Biochemistry, 1997, 36: 12948-12953.
Coulon A, Berkane E, Sautereau A, et al. Modes of membrane interaction of a natural cysteine-rich peptides:ViscotoxinA3. Biochimica et Biophysica Acta, 2002, 1559: 145-159.




