Актуальность исследования.
Перспективы применения пептидов в качестве ангиопротекторов
Cердечно-сосудистая патология (ССП) — одно из самых распространенных заболеваний с высоким уровнем риска смертности (Агеев Ф.Т., 2003). Основными причинами смертности являются ишемическая болезнь сердца (ИБС) и атеросклероз (Yano Y. et al., 2014; Wang M. et al., 2014). Согласно статистике Всемирной организации здравоохранения, более чем в 30% случаев причиной смерти является инфаркт миокарда. В России ССП составляет примерно 55% в структуре причин общей смертности.
На сегодняшний день наблюдается тенденция к снижению среднего возраста манифестации ССП (Гаврилова Н.Е. и др., 2013). В связи с этим поиск новых эффективных и безопасных средств, в том числе пептидной природы (Башкирёва А.С., Артамонова В.Г., 2012), для оптимизации функции сосудистой системы приобретает особое значение для лиц молодого и среднего возраста, особенно актуален для лиц, подвергающихся тяжелым физическим нагрузкам.
Целью настоящего исследования явилось изучение ангиопротекторных свойств пептида с условным названием IPH-AVN в культурах эндотелия крысы. Для достижения цели были поставлены следующие задачи:
-
Оценить влияние пептида IPH-AVN на экспрессию маркера пролиферации Ki67 и маркера апоптоза p53 в «молодых» и «старых» культурах эндотелиоцитов крысы.
-
Изучить влияние пептида IPH-AVN на экспрессию маркера ангиогенеза VEGF и маркера межклеточных контактов Cx43 в «молодых» и «старых» культурах эндотелиоцитов крысы.
-
Высказать предположение о механизмах вазопротекторного действия пептида IPH-AVN.
Материалы и методы исследования
2.1.Характеристика исследуемого материала
Объектами для морфофункционального исследования явились первичные культуры клеток стенки сосудов молодых крыс линии Вистар. Животных содержали в условиях вивария при комнатной температуре с 12-часовым циклом свет/темнота, свободным доступом к воде и пище, на стандартной диете в соответствии с нормами содержания лабораторных животных.
В работе были исследованы диссоциированные культуры клеток стенки сосудов крыс линии Вистар, 3 и 14 пассажи: 1- контроль (без добавления пептидов), 2 – добавление пептида IPH-AVN в концентрации 20 нг/мл, 3 – добавление пептида IPH-AЕN в концентрации 20 нг/мл. Таким образом, для изучения ангиопротекторных свойств пептида с условным названием IPH-AVN отрицательным контролем служил пептид IPH-AЕN. Для большинства диссоциированных клеточных культур, как было показано ранее, наиболее эффективной является концентрация пептидов 20 нг/мл (Линькова Н.С. и др., 2016; Khavinson V. et al., 2017). Поскольку ранее пептид IPH-AVN в диссоциированных культурах клеток не изучали, выбрали концентрацию 20 нг/мл, исходя из данных литературы.
Культивирование проводили до 3 пассажа и до 14 пассажа, на которых клетки были рассеяны на планшеты, и было произведено иммуноцитохимическое окрашивание. 3 пассаж расценивали как «молодые» культуры, а 14 пассаж – как «старые» культуры в соответствии с моделью клеточного старения пассажами.
Еще с 80-ых годов ХХ в. для исследования геропротекторных веществ используется две модели клеточного старения: пассажами и стационарного старения путем контактного торможения (Чирикова Е.Ю. и др., 1984). Границы и условия применимости этих моделей постоянно обсуждаются и в современной литературе (Хохлов А.Н., 2009; 2013; Хохлов А.Н. и др., 2014). Это связано с тем, что в работе с каждой культурой клеток приходится на основе общих рекомендаций подбирать индивидуальные условия культивирования и клеточного старения. Такое предварительное исследование, направленное на соблюдение общих рекомендаций и создания оптимальных условий старения первичной культуры эндотелиоцитов крысы, было проведено и в нашей работе.
2.2. Приготовление раствора пептидов для добавления в культуры клеток
Для исследования использовали пептиды IPH-AVN и IPH-AЕN в форме лиофилизированного порошка. Осуществляли последовательное разведение пептидов питательной средой для культивирования клеток до получения конечной концентрации раствора 20 нг/мл.
2.3. Выделение первичных культур эндотелиоцитов и хондроцитов крыс
Культуры эндотелия получали из аорты, а культуры хондроцитов – из хрящевой ткани задних конечностей крыс линии Вистар. Изолированную ткань сосуда или хряща измельчали и помещали в 0,2% раствор коллагеназы NB4 (Serva) в течение 30 мин при температуре 37 °С. Полученные клетки высаживали на культуральный пластик без подложки в ростовой среде DMEM/F12 (Invitrogen) с добавлением 10% фетальной бычьей сыворотки (foetal bovine serum, FBS; Autogene Bioclear), 100 Ед/мл пенициллина (Gibco), 100 Ед/мл стрептомицина (Gibco), 2 ммоль/л L-глутамина (Invitrogen). Смену среды проводили каждые трое суток. Для культивирования использовали среду DMEM/F12 (Invitrogen) с добавлением 10% FBS (Autogene Bioclear), 100 Ед/мл пенициллина (Gibco), 100 Ед/мл стрептомицина (Gibco), 2 ммоль/л L-глутамина (Invitrogen). Смену среды проводили каждые трое суток. Общий вид культур эндотелиоцитов и хондроцитов крысы представлен на рисунках 1 и 2.
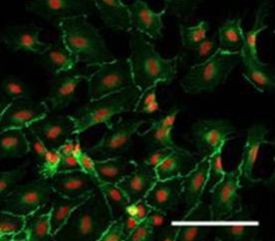
Рис. 1.Первичная культура эндотелиоцитов. Иммунофлуоресцентная конфокальная микроскопия. Из материалов статьи Kuosmanen S.M. et al., 2017.
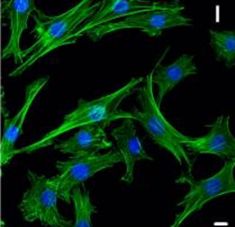
Рис. 2. Первичная культура хондроцитов. Иммунофлуоресцентная конфокальная микроскопия. Масштаб – 10 мкм. Зеленая флуоресценция – актиновый цитоскелет клеток, краситель Alexa Fluor 488. Синим флуоресцируют ядра, краситель DAPI. Из материалов статьи Mellor F.L. et al., 2014.
2.4. Иммунофлуоресцентная конфокальная микроскопия
Для иммуноцитохимического исследования эндотелиоцитов использовали следующие первичные антитела: Ki67 (разведение 1:50, Dako, США), p53 (разведение 1:100, Dako, США), VEGF (разведение 1:50, Dako, США), Cx43 (разведение 1:100, Abcam, Англия).
Указанные молекулы были выбраны для исследования, так как они играют важную роль в функционировании и старении эндотелия. Белок Ki67 является общепризнанным и широко используемым маркером пролиферации. Процесс старения характеризуется достижением предела Хейфлика и снижением либо полным прекращением способности клеток к делению. В связи с этим белок Ki67 может являться важным маркером для оценки снижения пролиферативной активности клеток и степени инволютивных процессов в исследуемом органе (Romero Q. et al., 2014). Белок р53 является транскрипционным фактором, выполняющим функцию супрессора образования злокачественных опухолей путем активации апоптоза в тканях организма. Белок р53 активируется при повреждениях ДНК, а также при стимулах, которые могут привести к подобным повреждениям, или являются сигналом о старении клетки и нарушении ее функциональной активности (Arshad H., et al., 2010). VEGF (фактор роста эндотелия сосудов) — сигнальный белок, вырабатываемый клетками для стимуляции васкулогенеза (образование эмбриональной сосудистой системы) и ангиогенеза (рост новых сосудов в уже существующей сосудистой системе) (Anteby E.Y. et al., 2004). Cx43 – gap junction alpha-1 protein (GJA1), коннексин 43. Коннексин 43 входит в семейство коннексинов, которые являются компонентами щелевых контактов, образующих межклеточные каналы и обеспечивающих диффузию низкомолекулярных соединений между соседними клетками. Коннексин 43 экспрессируется в клетках сосудов, включённых в атеросклеротические бляшки, в том числе в гладкомышечных клетках (Pfenniger A. et al., 2013). Иммуноцитохимию, иммунофлуоресцентную конфокальную микроскопию и морфометрию проводили по описанным ранее методикам (Kvetnoy I.M. et al., 2015).
Окрашивание препаратов проводили по стандартному протоколу:
- Промывка клеточной культуры раствором PBS.
- Фиксация клеток: для фиксации используется 4% раствор параформальдегида на PBS (инкубация в течение 15 минут при комнатной температуре).
- Промывка раствором PBS (три смены по 3 минуты).
- Отмывка дистиллированной водой (3 минуты).
- Пермеабилизация клеток осуществляется 0,25-0,5% раствором Triton X-100 на PBS (Биолот, РФ) в течение 15 минут при комнатной температуре.
- Промывка в трех сменах PBS (по 3 минуты).
- Инкубация в 1% бычьем сывороточном альбумине, разведенным PBS, pH 7,5 в течение 15 минут для блокировки неспецифического связывания.
- Промывка в трех сменах PBS (по 3 минуты).
- Инкубация с первичными антителами (время и условия инкубации установлены производителем в инструкции к антителам).
- Промывка в трех сменах PBS (по 3 минуты).
- Инкубация со вторичными антителами, конъюгированными с флуорохромом Alexa Fluor 488 или Alexa Fluor 647, в течение 30 минут при комнатной температуре в темноте.
- Промывка в трех сменах PBS (по 3 минуты).
- Готовые препараты заключить под покровные стекла в монтирующую среду Dako Fluorescent Mounting Medium (Dako, США) и хранить в темноте, во избежание быстрого выгорания флуорохрома.
2.5. Морфометрия
Для анализа полученных результатов использовали конфокальный микроскоп Olympus FluoView 1000 (Япония), программное обеспечение «Olympus FluoView ver 3.1b». В каждом случае анализировали 10 полей зрения при увеличении ×200. Проводили измерение относительной площади экспрессии в %. Относительную площадь экспрессии рассчитывали, как отношение площади, занимаемой иммунопозитивными клетками, к общей площади клеток в поле зрения и выражали в процентах для маркера с цитоплазматическим окрашиванием (VEGF, Cx43), а также как отношение площади, занимаемой иммунопозитивными ядрами, к общей площади ядер в поле зрения для маркеров с ядерной экспрессией (р53, Ki67).
2.6. Статистическая обработка результатов
Статистическая обработка экспериментальных данных включала в себя подсчет среднего арифметического, стандартного отклонения и доверительного интервала для каждой выборки и проводилась в программе Statistica 6.0. Для анализа вида распределения использовали критерий Шапиро-Уилка (Shapiro-Wilk’s W-test). Если данные подчинялись нормальному распределению, различия в средних определялись с помощью критерия Стюдента (t). В случаях, когда дисперсионный анализ выявлял статистически значимую неоднородность нескольких выборок, для последующего выявления неоднородных групп (путем их попарных сравнений) применяли процедуры множественных сравнений с помощью U-критерия Манна-Уитни. Критический уровень достоверности нулевой гипотезы (об отсутствии различий) принимали равным 0,05.
Результаты исследования и их обсуждение
Результаты исследования и их обсуждение.
Влияние пептида IPH AVNна экспрессию Ki67 и р53 в «молодых» и «старых» культурах эндотелиоцитов крысы.
Иммунофлуоресцентным методом было показано, что площадь экспрессии Ki67 в контроле «молодых» культур составила (2,7±0,2)%, что достоверно в 1,9 раза больше, чем в «старых культурах» — (1,1±0,1)%
Рис. 3. Влияние пептидов на экспрессию Ki67 в культуре сосудов эндотелия крысы. * — р <0,05 по сравнению с контрольной группой «молодые» культуры; ** — р <0,05 по сравнению с контрольной группой «старые» культуры.
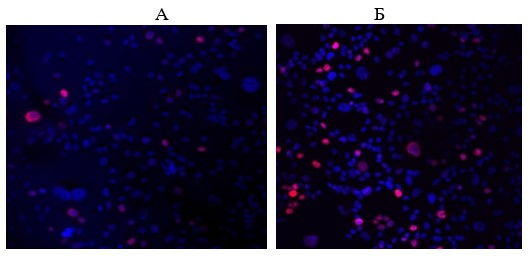
Рис. 4. Культура эндотелиоцитов 3 пассажа («молодая» культура), иммунофлуоресцентная конфокальная микроскопия, х200: А – контроль, Б – пептид IPH-AVN. Ядра клеток докрашены DAPI (синяя флуоресценция), экспрессия Ki67 — розовое свечение (Alexa Fluor 568).
Под действием пептида IPH-AVN происходило достоверное увеличение экспрессии Ki67 в «молодых» культурах в 1,7 раза (рис. 3, 4). В «старых» культурах пептид IPH-AVN повышал экспрессию Ki67 в 2 раза. Пептид IPH-AЕN не оказывал влияния на экспрессию Ki67 в культурах эндотелиоцитов (рис. 3). Экспрессия p53 в «молодых» культурах составила (1,3±0,2)%, а в «старых» культурах — (2,0±0,2)%. Пептид IPH-AVN снижал экспрессию р53 в 1,9 раза, но только в «молодых» культурах клеток (рис. 5). Пептид IPH-AЕN достоверно не изменял экспрессию данного маркера.
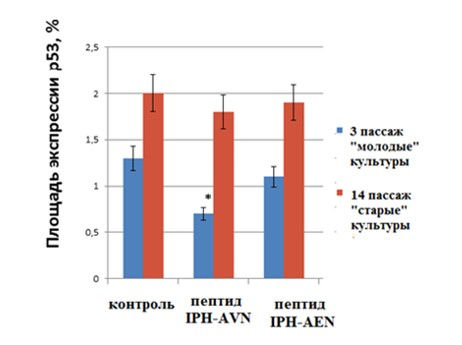
Рис. 5. Влияние пептидов на экспрессию р53 в культуре сосудов эндотелия крысы. * — р <0,05 по сравнению с контрольной группой «молодые» культуры.
3.2.Влияние пептида IPH-AVN на экспрессию VEGF и Cx43 в «молодых» и «старых» культурах эндотелиоцитов крысы
По данным, полученным с помощью конфокальной микроскопии, экспрессия VEGF в контроле в «молодых» и «старых» культурах эндотелия была одинаковой и составила (8,5±0,1)%. Пептид IPH-AVN увеличивал площадь экспрессии маркера как в «молодых», так и «старых культурах» в 1,7 и 1,6 раза соответственно (рис. 6. 7). Пептид IPH-AЕN не влиял на этот показатель (рис. 6).
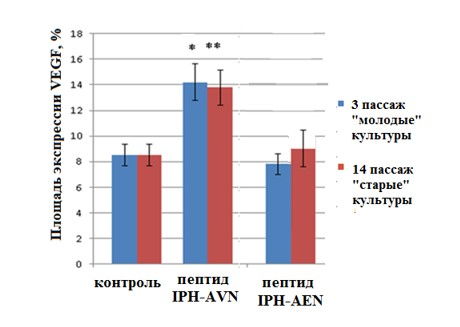
Рис. 6. Влияние пептидов на экспрессию VEGF в культуре сосудов эндотелия крысы. * — р <0,05 по сравнению с контрольной группой «молодые» культуры; ** — р <0,05 по сравнению с контрольной группой «старые» культуры.
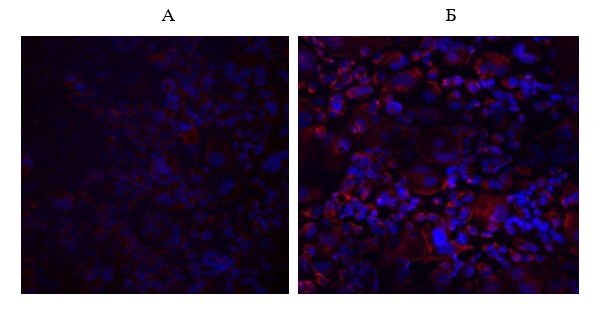
Рис. 7. Влияние пептида IPH-AVN на экспрессию фактора роста эндотелия сосудов VEGF в эндотелиоцитах крысы, 14 пассаж. Конфокальная микроскопия, х200: А – контроль, Б — пептид IPH-AVN. Ядра клеток докрашены DAPI (синяя флуоресценция), экспрессия VEGF темно-красное свечение (Alexa Fluor 568).
По данным, полученным с помощью конфокальной микроскопии, экспрессии маркера коннексина 43 в контроле в «молодых» культурах составила (5,9±0,1)%, а «старых» культурах — в 1,4 раза меньше — (4,3±0,1)%. Пептид IPH-AVN увеличивал площадь экспрессии Cx43 в «старых» культурах в 1,7 раза (рис. 8, 9), а на экспрессию в «молодых» культурах оказывал недостоверное воздействие. Пептид IPH-AЕN не влиял на экспрессию коннексина в «молодых» и «старых» культурах (рис. 8).
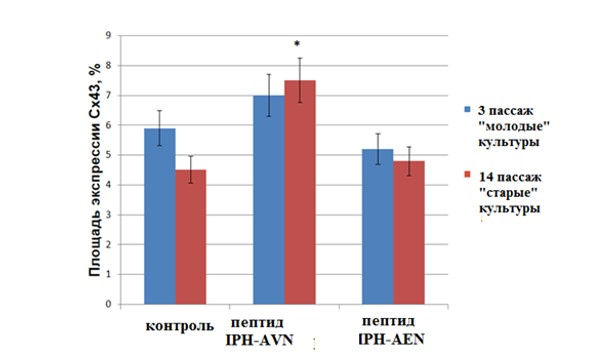
Рис. 8. Влияние пептидов на экспрессию Сх43 в культуре сосудов эндотелия крысы. * — р <0,05 по сравнению с контрольной группой «старые» культуры.
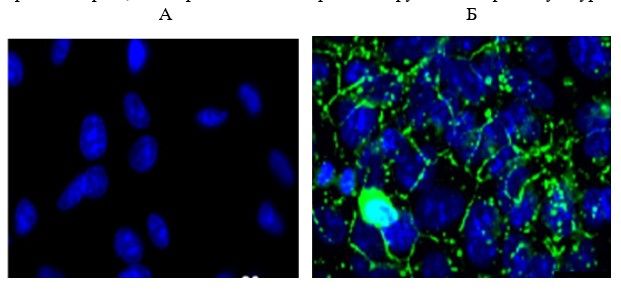
Рис. 9. Культура эндотелиоцитов крысы 14 пассажа («старая» культура), иммунофлуоресцентная конфокальная микроскопия, х400: А – контроль, Б – пептид IPH-AVN. Ядра клеток докрашены DAPI (синяя флуоресценция), экспрессия Cx43- зеленое свечение (Alexa Fluor 488).
Данные о влиянии пептида IPH-AVN на экспрессию белков Ki67, p53, VEGF, Cx43 в культурах эндотелиоцитов при их старении могут играть важную роль в понимании молекулярных механизмов ангиопротекторного действия этого пептида. Известно, что нарушение целостности эндотелиальной выстилки интимы артерий может быть вызвано апоптотической гибелью эндотелиальных клеток (ЭК). Причиной развития апоптоза ЭК может быть индукция перекисного окисления липидов и накопления активных радикалов кислорода, характерных при старении организма и при интенсивных физических нагрузках в молодом и среднем возрасте. При этом процессы апоптоза эндотелия сосудов интенсивно протекают только на ранних стадиях атеросклеротического процесса (Владимирская Т.Э. и др., 2013). Экспрессия Cx43 резко снижается в местах атеросклеротического поражения сосудов у человека и животных. Атеросклеротическое поражение аорты человека характеризуются резким уменьшением количества щелевых контактов, что определяется по снижению экспрессии Cx43. То есть при развитии атеросклеротических поражений разрушается трехмерная клеточная сеть, формируемая щелевыми соединениями (Orekhov A.N. et al., 2016). Следовательно, стимуляция пролиферации (экспрессия белка Ki67) и ангиогенеза (экспрессия фактора роста эндотелия сосудов VEGF), образование межклеточных контактов (экспрессия Сх43) и снижение апоптоза (белок р53) под действием пептида IPH-AVN могут указывать на способность этого пептида предотвращать развитие атеросклероза на его начальной стадии и защищать эндотелий сосудов от действия повреждающих факторов, включая процессы перекисного окисления липидов и образование активных радикалов кислорода.
Выводы
-
При старении эндотелия в культуре экспрессия Ki67 снижается в 1,9 раза. Пептид IPH-AVN повышает экспрессию пролифератропного белка Ki67 в «старых» культурах эндотелиоцитов крысы в 2 раза. При старении эндотелиоцитов в культуре экспрессия р53 повышается в 1,5 раза. Пептид IPH-AVN снижает экспрессию р53 в 1,9 раза в «молодых» культурах клеток.
-
При старении эндотелия в культуре экспрессия маркера ангиогенеза VEGF не изменяется. Пептид IPH-AVN увеличивает экспрессию VEGF в «молодых» и «старых» культурах эндотелия соответственно в 1,7 и 1,6 раза. При старении эндотелия в культуре экспрессия маркера межклеточных взаимодействий Сх43 снижается в 1,4 раза. Пептид IPH-AVN увеличивает экспрессию Cx43 в «старых» культурах в 1,7 раза.
-
Стимуляция пролиферации (экспрессия белка Ki67) и ангиогенеза (экспрессия фактора роста эндотелия сосудов VEGF), образования межклеточных контактов (экспрессия Сх43) и снижение апоптоза (белок р53) под действием пептида IPH-AVN могут указывать на способность этого пептида предотвращать развитие атеросклероза на его начальной стадии и служить ангиопротектором.
Литература
-
- 1. Агеев Ф.Т. Роль эндотелиальной дисфункции в развитии и прогрессировании сердечно-сосудистых заболеваний. Сердечная недостаточность. – 2003. — № 4. – 22 с.
- 2. Алексеева Л.И. Препараты замедленного действия в лечении остеоартроза // РМЖ. — 2012. — № 7. — С. 389–393.
- 3. Балабанова Р.М. Новый подход к лечению остеоартроза как хронического воспалительного заболевания // Современная ревматология. — 2013. — № 2. — С. 95–98.
- 4. Башкирёва А.С., Артамонова В.Г. Пептидергическая коррекция невротических состояний у водителей грузового автотранспорта// Успехи геронтологии. — 2012. — Т. 25. — № 4. — С. 718-728.
- 5. Владимирская Т.Э., Швед И.А., Криворот С.Г. Апоптоз клеток стенки коронарных артерий как фактор развития и прогрессирования коронаросклероза // Актуальные вопросы кардиологии. — 2013. — N 9. — P. 22–26.
- 6. Гаврилова Н.Е., Метельская В.А., Перова Н.В., Яровая Е.Б., Мазаев В.П., Уразалина С.Ж., Бойцов С.А. Взаимосвязь между выраженностью коронарного атеросклероза, факторами риска и маркерами атеросклеротического поражения каротидных и периферических артерий // Кардиоваскулярная терапия и профилактика. – 2013. – Т. 12. – № 1. – С. 40–45.
- 7. Демкин С.А., Маланин Д.А., Рогова Л.Н., Снигур Г.Л., Григорьева Н.В., Байдова К.В. Металлопротеиназы 1 и 13 как маркеры деструктивно-пролиферативного процесс суставного хряща при экспериментальном остеоартрозе // Вестник Волг ГМУ. – 2017. – Вып. 1 (61). – С. 69-73.
- 8. Линькова Н.С., Дробинцева А.О., Орлова О.А., Кузнецова Е.П., Полякова В.О., Кветной И.М., Хавинсон В.Х. Пептидная регуляция функций фибробластов кожи при их старении in vitro // Клеточные технологии в биологии и медицине. – 2016. — №1. – С. 40-44.
- 9. Олюнин Ю.А. Остеоартроз коленных суставов. Особенности диагностики и современные принципы лечения // РМЖ. — 2015. — №7. — С. 404.
- 10. Струков В.И., Джоунс О.В., Крутяков Е.Н. Способ диагностики остеопороза методом определения динамики закрытия полостных образований для оценки эффективности применения различных остеопротекторов// Патент на изобретение №2511430. Приоритет с 19.04.2012.
- 11. Хохлов А.Н. Тестирование геропротекторов в экспериментах на клеточных культурах: за и против // Проблемы старения и долголетия. — 2009. — Т. 18. — № 1. — С. 3236.
- 12. Хохлов А.Н. Эволюция термина «cellular senescence» и ее влияние на состояние современных цитогеронтологических исследований // Вестник Московского университета. Серия 16: Биология. — 2013. — №4. — С. 18-22.
- 13. Хохлов А.Н., Клебанов А.А., Кармушаков А.Ф., Шиловский Г.А., Насонов М.М., Моргунова Г.В. Тестирование геропротекторов в экспериментах на клеточных культурах: выбор оптимальной модельной системы // Вестник Московского университета. Серия 16: Биология. — 2014. — №1. — С. 13-18.
- 14. Arshad H., Ahmad Z., Hasan S.H. Gliomas: correlation of histologic grade, Ki67 and p53 expression with patient survival // Asian Pac J Cancer Prev. – 2010. – Vol. 11. – N 6. – P. 1637-1640.
- 15. Khavinson V., Linkova N., Kukanova E., Bolshakova A., Gainullina A., Tendler S., Morozova E., Tarnovskaya S., Vinski D.S.P., Bakulev V., Kasyanenko N. Neuroprotective Effect of EDR Peptide in Mouse Model of Huntington’s Disease // J. of Neurology and Neuroscience. – 2017. — Vol.8. — No.1:166. – P. 1-11.
- 16. Kuosmanen S.M., Kansanen E., Sihvola V., Levonen A.-L. MicroRNA Profiling Reveals Distinct Profiles for Tissue-Derived and Cultured Endothelial Cells// Sci Rep. 2017. Vol. 7. P. 10943.
- 17. Kvetnoy I.M., Paltsev M.A., Polyakova V.O. et al. Tau-Protein Expression in Human Buccal Epithelium: A Promising Non-Invasive Marker for Life-Time Diagnosis of Alzheimer’s Disease // Journal of Advanced Biomarkers Research. – 2015. – N1. – P. 1-6.
- 18. Mellor F.L., Baker T.L., Brown R.J., Catlin L.W., Oxford J.T. Optimal 3-D culture of primary articular chondrocytes for use in the Rotating Wall Vessel Bioreactor// Aviat Space Environ Med. – 2014. – Vol. 85, N 8. P. 798–804.
- 19. Orekhov A.N., Andreeva E.R., Bobryshev Y.V. Cellular mechanisms of human atherosclerosis: Role of cell-to-cell communications in subendothelial cell functions // Tissue Cell. — 2016. — V. 48. — N 1. — P. 25-34.
- 20. Pfenniger A., Chanson M., Kwak B.R. Connexins in atherosclerosis. // Biochim Biophys Acta. – 2013. – Vol. 1828 – N 1. – P. 157–166;
Romero Q., Bendahl P.O., Ferno M. et al. A novel model for Ki67 assessment in breast cancer. // Diagn Pathol. – 2014. – Vol. 16. – N 9. – P. 118. - 21. Wang M., Jiang L., Monticone R.E., Lakatta E.G. Proinflammation: the key to arterial aging. // Trends Endocrinol. Metab. – 2014. – Vol. 25. N 2. – P. 72–79.
- 22. Yano Y., Ning H., Allen N., Reis J.P., Launer L.J., Liu K., Yaffe K., Greenland P., Lloyd–Jones D.M. Long–Term Blood Pressure Variability Throughout Young Adulthood and Cognitive Function in Midlife: The Coronary Artery Risk Development in Young Adults (CARDIA) Study. // Hypertension. – 2014. – P. 983-989.




