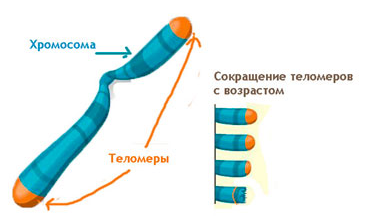
Теломеры-это комплексы белков с РНК, защищающие концевые участки хромосом линейной молекулы ДНК, которые состоят из повторяющейся последовательности нуклеотидов. У человека и других позвоночных повторяющееся звено имеет формулу TTAGGG (буквы обозначают нуклеиновые основания).
В 1971 году российский ученый Алексей Матвеевич Оловников впервые предположил, что при каждом делении клеток эти концевые участки хромосом укорачиваются что приводит к «репликативному старению» клетки.. То есть длина теломерных участков определяет «возраст» клетки — чем короче теломерный «хвост», тем она «старше». Через 15 лет это предположение экспериментально подтвердил английский ученый Говард Кук. Правда, нервные и мышечные клетки взрослого организма не делятся, теломерные участки в них не укорачиваются, а между тем они «стареют» и умирают. Поэтому вопрос о том, как «возраст» клетки связан с длиной теломер, остается по сей день открытым. Одно несомненно — теломеры служат своего рода счетчиком клеточных делений: чем они короче, тем большее число делений прошло с момента рождения клетки-предшественницы.
Фермент теломераза «работает» в раковых клетках, сперматозоидах и яйцеклетках. Его существование также было предсказано А. М. Оловниковым в начале 70-х годов. Обнаружили фермент в 1985 году у инфузории, затем — в дрожжах, растениях и у животных, в том числе в яичниках и раковых клетках человека.
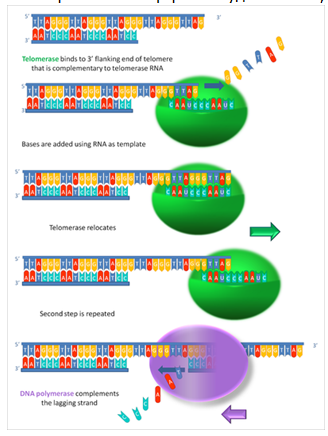
Теломераза — это фермент-«удлинитель», его функция — достраивать концевые участки линейных молекул ДНК, «пришивая» к ним повторяющиеся нуклеотидные последовательности — теломеры.(1,2) Клетки, в которых функционирует теломераза (половые, раковые), бессмертны. В обычных (соматических) клетках, из которых в основном и состоит организм, теломераза «не работает», поэтому теломеры при каждом делении клетки укорачиваются, что в конечном итоге приводит к ее гибели. В 1997 году американские ученые из университета Колорадо получили ген теломеразы. Затем в 1998-м исследователи из Юго-Западного медицинского центра Техасского университета в Далласе встроили ген теломеразы в клетки кожи, зрительного и сосудистого эпителия человека, где фермент в обычных условиях «не работает». В таких генетически модифицированных клетках теломераза находилась «в рабочем состоянии» — пришивала к концевым участкам ДНК нуклеотидные последовательности, поэтому длина теломер от деления к делению не менялась. Таким способом ученым удалось увеличить жизнь обычных клеток человека в полтора раза. Не исключено, что этот метод поможет найти ключ к продлению жизни.(1,2) Длина теломер, маркер клеточного старения, уменьшается с возрастом, и это связано с заболеваниями, связанными со старением. Факторы окружающей среды, в том числе факторы питания и образа жизни, влияют на скорость укорочения теломер, которая может быть устранена с помощью теломеразы. Предполагается, что активация теломеразы природными молекулами является антивозрастным модулятором, который может играть роль в лечении заболеваний, связанных со старением.(3) Некоторые исследования показали, что короткая длина теломер связана с заболеваниями, связанными со старением, включая сердечно-сосудистые заболевания (ИБС), инсульт, рак, артрит, остеопороз, катаракту, диабет 2 типа, гипертонию, психические заболевания, хроническую обструктивную болезнь легких (ХОБЛ) и слабоумие ( 1 ). На укорочение теломер могут влиять такие факторы окружающей среды, как физическая активность, индекс массы тела (ИМТ), заместительная гормональная терапия, курение, хроническое воспаление, окислительный стресс, пищевые антиоксиданты и витамины (4 — 5 ). Например, повреждение ДНК, вызванное различными факторами окружающей среды, вызывает реакцию повреждения ДНК на теломерах, которая защищает их от нестабильности и укорочения (6, 7). Предполагается, что длина теломер является биомаркером старения соматических клеток, тогда как скорость роста коротких теломер связана с продолжительностью жизни млекопитающих (8,9). Действительно, когда длина теломер укорачивается ниже порогового предела, рост клеток ограничивается, и клетки подвергаются клеточному старению или апоптозу ( 10).
В настоящее время ведущие мировые институты занимаются изучением природных веществ (растений, минералов) которые могут влиять на скорость укорочения теломер. В ряде исследований было установлено, что введение пищевых добавок может быть связано с поддержанием длины теломер у здоровых взрослых (11, 12).
Одним из таких модуляторов длины теломер является экстракт корня Astragalus membranaceus. Ряд исследований выявили наличие циклоастрагенола (CAG) соединения тритерпеноидного сапонина, который увеличил активность теломеразы и уменьшил эффекты старения (13)
Так же высокие свойства активатора теломеразы выявлены комплексом тритерпенов в экстракте Centella asiatica (3)
Ряд исследований на клетках человека продемонстрировали, что отсутствие магния и недостаток цинка приводит к стремительной деградации теломер и подавляет деление клеток (14), а витамин С замедляет укорочение теломер (15) Последнее время все больше и больше ученых обращают внимание на защищающее действие карнозина на теломеры. Карнозин (бета-аланил-L-гистидин)—дипептид, состоящий из остатков аминокисло β-аланина и гистидина. В процессах, которые реализуются клеткой при защите от окислительного стресса, задействованы совершенно различные активности карнозина, включая прямое взаимодействие и стабилизацию (защиту) супероксиддисмутазы, подавление перекисного окисления липидов, торможение продукции АФК, защиту теломер, трансгликирование, воздействие на редокс-регуляцию, протеолиз, функциональную активность протеасом и эпигенетическую регуляцию. При исследовании действия карнозина на культуры клеток было обнаружено, что помимо уже известных активностей: увеличения предела Хейфлика и морфологического омоложения клеток – карнозин стимулирует клеточные деления в тесте колониеобразования и тормозит процесс перехода клеток в состояние покоя. При анализе изменений в транскриптоме, происходящих под действием карнозина, выявлено, что основные сдвиги связаны с позитивной регуляцией клеточного цикла на всех уровнях – от начала синтеза ДНК до конденсации хромосом. Можно предположить, что именно способность карнозина стимулировать клеточный цикл лежит в основе его омолаживающего действия, а высокие концентрации этого дипептида в мышечной ткани играют роль не только физиологического буфера, но и необходимы для восстановления (регенерации) клеток организма(16)
Таким образом, влияние на скорость укорочения теломер, а значит и удлинение жизни клеток организма человека возможно с помощью природных веществ. Использование этих пищевых добавок позволит увеличить длину жизни человека и улучшить ее качество в зрелом возрасте.
1- Наука и жизнь, ТЕЛОМЕРЫ — СЧЕТЧИК ДОЛГОЛЕТИЯ ( №9 сентябрь 2019)
2- Блэкберн Э.Х., Чан С., Чанг Дж., Фултон Т.Б., Краускопф А., Мак-Ичерн М., Прескотт Дж., Рой Дж., Смит С., Ван Х. Молекулярные проявления и молекулярные детерминанты теломерного кэппинга. Cold Spring Harb Symp Квант Биол. 2000; 65 : 253–263
3- Discovery of potent telomerase activators: Unfolding new therapeutic and anti-aging perspectives (Dimitris Tsoukalas, Persefoni Fragkiadaki Anca Oana Docea, Athanasios K. Alegakis Evangelia Sarandi Maria Thanasoula Demetrios A. Spandidos Aristidis Tsatsakis, Mayya Petrovna Razgonova and Daniela Calina )
4-Telomeres and age-related disease: how telomere biology informs clinical paradigms. Armanios M
5-Higher serum vitamin D concentrations are associated with longer leukocyte telomere length in women. Richards JB, Valdes AM, Gardner JP, Paximadas D, Kimura M, Nessa A, Lu X, Surdulescu GL, Swaminathan R, Spector TD, Aviv A Am J Clin Nutr. 2007 Nov; 86(5):1420-5.
- Thanasoula M, Escandell JM, Martinez P, Badie S, Muñoz P, Blasco MA, Tarsounas M. p53 prevents entry into mitosis with uncapped telomeres.
- Thanasoula M, Escandell JM, Suwaki N, Tarsounas M. ATM/ATR checkpoint activation downregulates CDC25C to prevent mitotic entry with uncapped telomeres.
8.Vakonaki E, Tzatzarakis M, Tsiminikaki K, Nathena D, Fragkiadaki P, Kalliantasi K, Kanaki K, Vaki G, Plaitis S, Tsoukalas D, et al. Effect of chronic and heavy drug abuse on biological aging. World Acad Sci J. 2019;1:67–73.
- Vera E, Bernardes de Jesus B, Foronda M, Flores JM, Blasco MA. The rate of increase of short telomeres predicts longevity in mammals. Cell Rep. 2012;2:732–737.
- Shay JW, Wright WE. Hallmarks of telomeres in ageing research. J Pathol. 2007;211:114–123.
- Tsoukalas D, Fragkiadaki P, Docea AO, Alegakis AK, Sarandi E, Vakonaki E, Salataj E, Kouvidi E, Nikitovic D, Kovatsi L, et al. Association of nutraceutical supplements with longer telomere length. Int J Mol Med. 2019;44:218–226.
12 . Yu Y, Zhou L, Yang Y, Liu Y. Cycloastragenol: An exciting novel candidate for age-associated diseases. Exp Ther Med. 2018;16:2175–2182.
- Fauce SR, Jamieson BD, Chin AC, Mitsuyasu RT, Parish ST, Ng HL, Kitchen CM, Yang OO, Harley CB, Effros RB. Telomerase-based pharmacologic enhancement of antiviral function of human CD8+ T lymphocytes. J Immunol. 2008
14 М.Ж. Жумагул, А.К. Кыдырбаева, Г.Т. Танеева, Г.Т. Какишева, И.К. Нурпеисова Казахский Медицинский Университет имени С.Д. Асфендиярова, кафедра молекулярной биологии и медицинской генетики ВЛИЯНИЕ ЭПИГЕНЕТИЧЕСКИХ ФАКТОРОВ НА УКОРОЧЕНИЕ ТЕЛОМЕР https://cyberleninka.ru/article/n/vliyanie-epigeneticheskih-faktorov-na-ukorochenie-telomer
15 Oschman JL. //Chronic disease: are we missing something? // Journal of Alternative and Complementary Medicine. — 2011. — №17(4). -Р. 283-285.
16 Shao L., Li Q.H., Tan Z.M. 2004. L6carnosine reduces telomere damage and shortening rate in cultured nor6 mal fibroblasts. Biochem. Biophys. Res. Commun. 324, 931–936




