В этой статье обобщены возможные преимущества мелатонина в ослаблении COVID-19 на основе его предполагаемого патогенеза. Недавняя вспышка COVID-19 стала пандемией с десятками тысяч инфицированных пациентов. Исходя из клинических особенностей, патологии, патогенеза острого респираторного расстройства, вызванного высоко гомогенные коронавирусы или другие патогенные микроорганизмы, данные свидетельствуют о том, что чрезмерное воспаление, окисление, и преувеличенный иммунный ответ очень вероятно способствует патологии COVID-19. Это приводит к цитокиновый шторм и последующее прогрессирование до острого повреждения легких (ALI) / острого респираторного дистресс-синдрома (ARDS) и часто смерть. Мелатонин, хорошо известная противовоспалительная и антиоксидантная молекула, защищает против ALI / ARDS, вызванных вирусными и другими возбудителями. Мелатонин эффективен у пациентов интенсивной терапии, уменьшая проницаемость сосудов, беспокойство, использование седативных средств и улучшение качества сна, что также может быть полезным для улучшения клинических результатов у пациентов с COVID-19. Примечательно, что мелатонин имеет высокий профиль безопасности. Есть значительный данные, показывающие, что мелатонин ограничивает связанные с вирусом заболевания и, вероятно, также будет полезен при Covid-19 пациентов. Дополнительные эксперименты и клинические исследования необходимы для подтверждения этого предположения.
Коронавирусы (CoVs) — это РНК-вирусы, заражающие как человека, так и животных; эта инфекция поражает органы дыхания, желудочно-кишечный тракт и центральную нервную систему [1]. Тяжелый острый респираторный синдром коронавирус (SARS-CoV) и ближневосточный респираторный синдром коронавируса (MERS-CoV) являются заразными и смертельными, и вызвали тысячи смертей за последние два десятилетия. Недавняя вспышка была обнаружена в Ухане, Китай; это очень заразное заболевание распространилось по всему Китаю и другим странам [2]. Хотя противовирусная терапия, кортикостероидная терапия и механическая респираторная поддержка были применены, нет специфического лечения для COVID-19 [2].
Мелатонин (N-ацетил-5-метокситриптамин) является биологически активной молекулой с целым рядом укрепляющих здоровье свойств; мелатонин успешно применяется для лечения нарушений сна, бреда, атеросклероза, дыхательных путей болезни и вирусные инфекции [3]. Предыдущие исследования документировали положительные эффекты мелатонина в облегчении острого респираторного стресса, вызванный вирусом, бактериями, радиацией и т. д. [4–6]. Здесь мы рассмотрим доказательства того, что мелатонин будет оказывать полезность адъюванта при лечении вызванной COVID-19 пневмонии, острой легкого травмы (ALI) и острый респираторный дистресс-синдром (ARDS).
Патогенез COVID-19 и обоснование использования мелатонина
Пациенты с COVID-19 (инфицированные SARS-CoV-2) сообщают о наличии лихорадки, сухого кашля, миалгии, усталости и диареи, и т.д. с симптомами, несколько различающимися с возрастом пациентов. В некоторых случаях серьезное прогрессирование заболевания приводит к ALI / ARDS, дыхательная недостаточность, сердечная недостаточность, сепсис и внезапная остановка сердца в течение нескольких дней [2,7]. Патогенная экспертиза образцов легких от умеренных пациентов с COVID-19 (которые были ретроспективно COVID-19 во время операции по раку легкого) показал отек, белковый экссудат с глобулами, очаговая воспалительная клеточная инфильтрация и умеренное образование гиалиновых мембран [8]. Посмертно обследование пациента с COVID-19 с тяжелой формой ОРДС, образцы зараженных легких продемонстрировали двустороннее диффузное альвеолярное повреждение с отеком, десквамацией пневмоцитов и гиалиновой мембраной формирование [9].
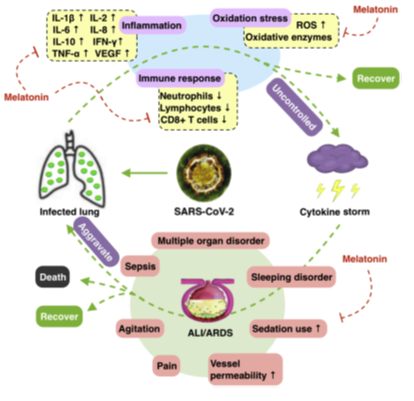
Рис. 1. Патогенез COVID-19 и потенциальное адъювантное применение мелатонина.
Мы предположили, что легкие инфицированы SARS-CoV-2, и подавленный иммунный ответ,
повышенное воспаление и чрезмерный окислительный стресс не ослабевают, что приводит к активации цитокиновой бури. ALI / ARDS может последовать в сопровождении ряд осложнений, исходы которых варьируются в зависимости от тяжести заболевания. Мелатонин может играть роль вспомогательного лекарственного средства в регуляции иммунная система, воспаление и окислительный стресс, а также оказывают поддержку пациентам с ALI / ARDS и связанными с этим осложнениями. ALI: Острое повреждение легких; ARDS: Острый респираторный дистресс-синдром.
Хотя эти патологические сообщения были зарегистрированы только в небольшом ряде случаев находки напоминают патологические признаки обнаружен при SARS- и MERS-индуцированной пневмонии [10]. SARS-CoVs, MERSCoVs и SARS-CoV-2 классифицированы как члены семейства бета-коронавирусов [11]. Недавние опубликованные исследования показывают, что акции SARS-CoV-2
79,0% идентичности нуклеотидов с SARS-CoV и 51,8% идентичности с MERSCoV [12], что указывает на высокую генетическую гомологию среди SARS-CoV-2, MERS-CoV и SARS-CoV. У инфицированных SARS-CoV и MERS-CoV животных модели, отмеченные воспалительные и иммунные реакции могут активироваться «шторм цитокинов» и апоптоз эпителиальных клеток и эндотелия клетки; впоследствии утечка сосудов, аномальные Т-клетки и макрофаги. Реакция возникает и вызывает ALI / ARDS или даже смерть [13].
На основании генетической гомологии и патологических особенностей инфицированных
мы предсказали, что у пациентов с COVID-19. В крови пациентов с COVID-19 отмечалась выраженная увеличение интерлейкина 1β (IL-1β), интерферона γ (IFN-γ), интерферон-индуцируемого белок 10 (IP-10) и моноцитарный хемоаттрактантный белок 1
(MCP-1), а также IL-4 и IL-10 по сравнению с SARS пациентов. Это предполагает некоторое потенциальное отличие от SARS и MERS в патогенезе коронавируса [2]. Существует также потенциал подавления иммунная функция у пациентов с COVID-19 с гипоальбуминемией,
лимфопения, нейтропения и снижение процента CD8 + T ячейка [2,7]. Недавние сообщения предполагают, что у некоторых пациентов с COVID-19, хотя быть отрицательным для теста на вирусную нуклеиновую кислоту, все еще иногда присутствует с высоким уровнем воспаления. Клиническое исследование с использованием цертолизумаба pegol (блокатор TNF) наряду с другими антивирусными терапиями может иметь положительные эффекты у пациентов с COVID-19. В совокупности обнаружение указывает на то, что воспаление является основной особенностью COVID-19 пациентов. Таким образом, мы предполагаем, что чрезмерное воспаление, депрессия Иммунная система и активация цитокинового шторма существенно способствуют к патогенезу COVID-19.
На ранних стадиях коронавирусной инфекции, дендритных клеток и эпителиальные клетки активируются и экспрессируют провоспалительные кластеры цитокины и хемокины, включая IL-1β, IL-2, IL-6, IL-8, оба IFN-α / β, фактор некроза опухоли (TNF), мотив CeC хемокин 3 (CCL3), CCL5,
CCL2, IP-10 и т. Д. Они находятся под контролем иммунной системы.
Таким образом, перепроизводство этих цитокинов и хемокинов способствует развитию болезни [14–16]. IL-10, продуцируемый T-helper-2 (Th2), является противовирусным, с инфекцией
коронавирусов, приводящих к заметному снижению этого агента [17,18].
Интересно, что пациенты с COVID-19 иногда имеют значительно повышенный уровень ИЛ-10 [2]. Является ли это особенностью инфекции COVID-19 или результат лечения неизвестен. Усиление
воспалительного ответа будет способствовать клеточному апоптозу или некрозу пораженных клеток, который будет способствовать воспалению, с последующим увеличением проницаемости кровеносных сосудов и аберрантных накопление воспалительных моноцитов, макрофагов и нейтрофилов в альвеолах легких [19]. Этот замкнутый круг усилит ситуация как регуляция иммунного ответа теряется и цитокиновый шторм далее активируется, что приводит к тяжелым последствиям.
Эта предполагаемая патология «цитокиновый шторм», связанная с коронавирусами также поддерживается экспериментальными моделями SARS-CoV, одной из который показал, что тяжесть ALI сопровождалась повышенной экспрессией генов, связанных с воспалением, а не увеличение вирусных Титры. В другом случае происходит абляция рецептора IFN-α / β или истощение воспалительных моноцитов / макрофагов вызвало заметное увеличение выживаемости коронавирусов -хозяев без изменения вирусной нагрузки [19,20]. Обе ситуации предполагают потенциальный механизм усиления в CoV-индуцированной ALI / ARDS независимо от вирусной нагрузки. Если похожая патология также существует в COVID-19, ослабление цитокинового шторма, ориентируясь на несколько ключевых шагов в процессе, может привести к улучшенные результаты.
Мелатонин не обладает противовирусным действием, но обладает непрямым противовирусным действием [3] благодаря своим противовоспалительным, антиоксидантным и иммунным
особенности [21–24]. Есть ситуации, в которых мелатонин подавляет особенности вирусных инфекций. У мышей с центральной нервной системой зараженный вирусом (например, энцефалитом), использование мелатонина вызывало меньше виремия, снижение паралича и смертности, а также снижение вирусной нагрузки [25]. В предыдущие модели респираторно-синцитиального вируса, мелатонин вызвал подавление острого окислительного повреждения легких, провоспалительный цитокин высвобождение и рекрутирование воспалительных клеток. Эти выводы, наряду с недавно обобщенные Reiter et al. [3], поддержать обоснование использование мелатонина при вирусных заболеваниях. Кроме того, противовоспалительное действие мелатонина, антиоксидантные, иммуностимулирующие действия способствуют его потенциальному ослаблению инфекции COVID-19 (рис. 1).
Мелатонин и противовоспалительное
Мелатонин оказывает противовоспалительное действие различными путями. Сиртуин-1 (SIRT1) может опосредовать противовоспалительное действие мелатонин путем ингибирования группы высокой мобильности боксехромосомного белка 1 (HMGB1), и, таким образом, подавление поляризации макрофагов в сторону провоспалительного типа [26]. В вызванной сепсисом ALI,
Правильная регуляция SIRT1 ослабляет повреждение легких и воспаление, в что применение мелатонина может быть полезным [27]. Ядерной фактор каппа-B (NF-κB) тесно связан с провоспалительным и проокислительные ответы, являясь медиатором воспаления при ALI.
Противовоспалительное действие мелатонина включает подавление Активация NF-κB в ОРДС [28, 29]. Мелатонин по сообщениям подавляет Активация NF-κB в Т-клетках и ткани легких [30,31]. Стимуляция Фактор 2, связанный с NF-E2 (Nrf2), имеет решающее значение для защиты легких от травм.
В связанных исследованиях мелатонин индуцирует активацию Nrf2 с терапевтические эффекты при гепатопротекции, кардиопротекции и др. [32]. Вовлечен ли Nrf2 в CoV-индуцированную ALI, остается неизвестным, но тесное взаимодействие SIRT1, NF-κB и Nrf2 предполагает их участие
в CoV-индуцированной ALI / ARDS. Таким образом, данные поддерживают потенциальное противовоспалительное действие мелатонина. Воспаление обычно связаны с повышенной продукцией цитокинов и хемокины, в то время как мелатонин вызывает уменьшение провоспалительных цитокины. TNF-α, IL-1β, IL-6 и IL-8, а также повышение уровня противовоспалительного цитокина IL-10 [33,34]. Может быть, тем не менее, некоторые опасения по поводу потенциальных провоспалительных действий мелатонина при использовании в очень высоких дозах или при подавленном иммунном условия, в которых это может вызвать увеличение производства провоспалительных цитокины, IL-1β, IL-2, IL-6, IL-12, TNF-α и IFN-γ [35].
Наоборот, в моделях инфекции ALI мелатонин обладает противовоспалительным действием.
и защитное действие [6].
Мелатонин и антиоксидант
Антиоксидантный эффект мелатонина взаимодействует с его противовоспалительным
действием, усиливающие антиоксидантные ферменты (например, супероксид дисмутаза), подавляющие проокислительные ферменты (например, азотные оксида синтазы), и он также может взаимодействовать непосредственно со свободными радикалами, функционирующий как поглотитель свободных радикалов [3,4]. Вирусные инфекции и их Репликация постоянно генерирует окисленные продукты. При ОРВИ Модель ALI, производство окисленного липопротеина низкой плотности активирует врожденный иммунный ответ при перепроизводстве альвеолярных макрофагов IL-6 посредством передачи сигналов Toll-подобного рецептора 4 (TLR4) / NF-kB, тем самым приводя к ALI [36]. TLR4 является рецептором врожденной иммунной системы,
и это также терапевтическая мишень для мелатонина. При ишемии мозга, модели гастрита и пародонтита, мелатонин документировал противовоспалительное действие через передачу сигналов TLR4 [37–39]. Антиоксидантный эффект мелатонина был также подтвержден при ALI, вызванном радиацией, сепсисом и ишемией-реперфузей [4,40,41]. У пациентов с ALI / ARDS,
особенно когда болезнь прогрессирует и у пациентов, которых лечат в отделениях интенсивной терапии (ОИТ), при тяжелом воспалении, гипоксемии и механическом вентиляция с высокими концентрациями кислорода неизбежно увеличивается выработка окислителей локально и систематически [42,43]. Соответственно, мы предполагаем, что чрезмерное окисление также, вероятно, участвует в COVID-19. Обширные исследования Gitto et al. [44,45], который использовал
мелатонин для лечения новорожденных с дыхательной недостаточностью, имеет задокументировано антиоксидантное и противовоспалительное действие мелатонина
в легких. Таким образом, вполне вероятно, что применение мелатонина было бы полезно в борьбе с воспалением и окислением в зараженные коронавирусом субъекты.
Влияние мелатонина на уровень цитокинов у человека
Хотя, очевидно, нет никаких сообщений, связанных с использованием мелатонина у пациентов с COVID-19, у субъектов с другими заболеваниями и повышенной уровень воспаления при применении мелатонина показал перспективность результаты, касающиеся снижения уровня циркулирующих цитокинов. В
рандомизированное контролируемое исследование, 8-недельное пероральное введение 6 мг / сут мелатонина вызывал значительное снижение сывороточных уровней IL-6, TNF-α и hs-Creactive
белок (hs-CRP) у пациентов с сахарным диабетом и периодонтитом [56]. В другом исследовании пациентов, страдающих тяжелым множественным склероз, перорально 25 мг / сут мелатонина в течение 6 месяцев также способствовал значительное снижение сывороточных концентраций TNF-α, IL-6, IL-1β и липопероксиды [57]. В острой фазе воспаления, в том числе во время хирургического стресса [58], реперфузии головного мозга [59] и коронарной артерии реперфузия [60], прием мелатонина 10 мг / сут, 6 мг / сут и 5 мг / сут мелатонин менее 5 дней вызывал снижение провоспалительного уровня цитокины. Недавний мета-анализ в общей сложности 22 рандомизированных контролируемые испытания предположили, что дополнительное использование мелатонина связано со значительным снижением уровня TNF-α и IL-6 [61].
Эти клинические данные свидетельствуют о том, что применение мелатонина в качестве добавки
может эффективно снижать уровни циркулирующих цитокинов, и потенциально может также снизить уровни провоспалительных цитокинов в COVID-19 пациентов.
Мелатонин и другие вспомогательные эффекты
Целостность сосудистого эндотелиального барьера имеет решающее значение в иммунорегуляция внутри альвеол. Сильное воспаление и иммунитет ответы вызывают апоптоз эпителиальных и эндотелиальных клеток, а также увеличение производства VEGF, который усугубляет отек и экстравазацию иммунных клеток из кровеносных сосудов. Экспериментальный
данные свидетельствуют о том, что мелатонин опосредует подавление VEGF в эндотелиальные клетки сосудов [62]. На основании клинических отчетов COVID-19, Пациенты с тяжелой формой ALI / ARDS могут также иметь повышенный риск сепсиса и остановка сердца [2]. Опубликованные отчеты показывают, что применение мелатонин может ослабить септический шок через путь NLRP3 [63]. В частности, мелатонин может оказывать профилактическое действие против вызванное сепсисом повреждение почек, септическая кардиомиопатия и повреждение печени
[64-66]. Также сообщалось, что мелатонин имел преимущества у пациентов при инфаркте миокарда, кардиомиопатии, гипертонической болезни сердца и легочная гипертензия, и, вероятно, функционирует через TLR4 / путь усиления активирующего фактора выживания [67]. Более того, мелатонин оказывает неврологическую защиту, уменьшая воспаление мозга
реакция, отек мозга и проницаемость гематоэнцефалического барьера в ряде экспериментальных условий [68]. В отделении интенсивной терапии, глубокий седативный эффект связан с увеличением долгосрочной смертности, а применение мелатонина уменьшает использование седативных средств и частоту боль, возбуждение, беспокойство [69,70]. Кроме того, недавний метаанализ показал, тот мелатонин улучшает качество сна у пациентов в отделении интенсивной терапии [71]. Таким образом, обоснование применения мелатонина у пациентов с хронической коррозийной недостаточностью не только фокусируется на ослаблении респираторных заболеваний, вызванных инфекцией, но и на общее улучшение и профилактику пациентов благополучие и возможные осложнения.
Мелатонин и безопасность
При рассмотрении использования мелатонина для лечения COVID-19, безопасность мелатонина имеет первостепенное значение для рассмотрения. Как проверено ранее краткосрочное использование мелатонина безопасно, даже в тех учитывая высокие дозы, и сообщаемые побочные эффекты ограничены случайными головокружение, головная боль, тошнота и сонливость; в общем мелатонин безопасность у людей очень высока [72]. В клинических испытаниях, дозы 3 мг, пероральный прием 6 мг и 10 мг мелатонина пациентами в отделениях интенсивной терапии показал удовлетворительная безопасность по сравнению с плацебо [70,73,74]. Кроме того, даже когда мелатонин давали людям в дозе 1 г / сут в течение месяца,
не было никаких неблагоприятных сообщений о лечении [75]. Наконец-то были после применения мелатонина при ALI / ARDS побочных эффектов не зарегистрировано исследования на животных [3,4,28]. Пока безопасность мелатонина была проверена во многих исследованиях на людях, его эффект при назначении пациентам с COVID-19 следует тщательно контролировать, несмотря на очень высокий профиль безопасности мелатонин.
Выводы
Возможные положительные эффекты мелатонина в качестве адъюванта при использовании в
COVID-19 в противовоспалительной, антиоксидантной, регуляции иммунного ответа был неоднократно продемонстрирован при расстройстве дыхания модели, вызванные инфекциями и связанными с ними осложнениями. Мелатонин имеет высокий профиль безопасности. Хотя прямое доказательство мелатонина Применение COVID-19 неясно, как его использование у экспериментальных животных модели и в исследованиях на людях постоянно документировали его эффективность и безопасность и его использование пациентами COVID-19, как и ожидалось, будет очень выгодно
References
[1] J. Cui, F. Li, Z.-L. Shi, Origin and evolution of pathogenic coronaviruses, Nat. Rev.
Microbiol. 17 (2019) 181–192, https://doi.org/10.1038/s41579-018-0118-9.
[2] C. Huang, Y. Wang, X. Li, L. Ren, J. Zhao, Y. Hu, L. Zhang, G. Fan, J. Xu, X. Gu,
-
Cheng, T. Yu, J. Xia, Y. Wei, W. Wu, X. Xie, W. Yin, H. Li, M. Liu, Y. Xiao, H. Gao,
-
Guo, J. Xie, G. Wang, R. Jiang, Z. Gao, Q. Jin, J. Wang, B. Cao, Clinical features of
patients infected with 2019 novel coronavirus in Wuhan, China, Lancet (London,
England) 395 (2020) 497–506, https://doi.org/10.1016/S0140-6736(20)30183-5.
[3] R.J. Reiter, Q. Ma, R. Sharma, Treatment of Ebola and other infectious diseases:
melatonin “goes viral”, Melatonin Res 3 (2020) 43–57, https://doi.org/10.32794/
mr11250047.
[4] X. Wu, H. Ji, Y. Wang, C. Gu, W. Gu, L. Hu, L. Zhu, Melatonin alleviates radiationinduced
lung injury via regulation of miR-30e/NLRP3 axis, Oxidative Med. Cell.
Longev. 2019 (2019) 4087298, https://doi.org/10.1155/2019/4087298.
[5] H.-K. Yip, Y.-C. Chang, C.G. Wallace, L.-T. Chang, T.-H. Tsai, Y.-L. Chen, H.-
-
Chang, S. Leu, Y.-Y. Zhen, C.-Y. Tsai, K.-H. Yeh, C.-K. Sun, C.-H. Yen, Melatonin
treatment improves adipose-derived mesenchymal stem cell therapy for acute lung
ischemia-reperfusion injury, J. Pineal Res. 54 (2013) 207–221, https://doi.org/10.
1111/jpi.12020.
[6] S.-H. Huang, X.-J. Cao, W. Liu, X.-Y. Shi, W. Wei, Inhibitory effect of melatonin on
lung oxidative stress induced by respiratory syncytial virus infection in mice, J.
Pineal Res. 48 (2010) 109–116, https://doi.org/10.1111/j.1600-079X.2009.
00733.x.
[7] N. Chen, M. Zhou, X. Dong, J. Qu, F. Gong, Y. Han, Y. Qiu, J. Wang, Y. Liu, Y. Wei,
-
Xia, T. Yu, X. Zhang, L. Zhang, Epidemiological and clinical characteristics of 99
cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study,
Lancet (London, England) 395 (2020) 507–513, https://doi.org/10.1016/S0140-
6736(20)30211-7.
[8] S. Tian, W. Hu, L. Niu, H. Liu, H. Xu, S. Xiao, Pulmonary Pathology of Early Phase
SARSCoV-2 Pneumonia, Preprints (Www.Preprints.Org), 2020, https://doi.org/10.
20944/preprints202002.0220.v1 [Epub ahead of print].
[9] Z. Xu, L. Shi, Y. Wang, J. Zhang, L. Huang, C. Zhang, S. Liu, P. Zhao, H. Liu, L. Zhu,
-
Tai, C. Bai, T. Gao, J. Song, P. Xia, J. Dong, J. Zhao, F.-S. Wang, Pathological
findings of COVID-19 associated with acute respiratory distress syndrome, Lancet
Respir. Med. (2020), https://doi.org/10.1016/S2213-2600(20)30076-X Epub
ahead of print.
[10] J. Liu, X. Zheng, Q. Tong, W. Li, B. Wang, K. Sutter, M. Trilling, M. Lu, U. Dittmer,
-
Yang, Overlapping and discrete aspects of the pathology and pathogenesis of the
emerging human pathogenic coronaviruses SARS-CoV, MERS-CoV, and 2019-nCoV,
-
Med. Virol. (2020), https://doi.org/10.1002/jmv.25709 Epub ahead of print.
[11] J. Chen, Pathogenicity and transmissibility of 2019-nCoV-A quick overview and
comparison with other emerging viruses, Microbes Infect. (2020), https://doi.org/
10.1016/j.micinf.2020.01.004.
[12] L.-L. Ren, Y.-M. Wang, Z.-Q. Wu, Z.-C. Xiang, L. Guo, T. Xu, Y.-Z. Jiang, Y. Xiong, Y.-
-
Li, X.-W. Li, H. Li, G.-H. Fan, X.-Y. Gu, Y. Xiao, H. Gao, J.-Y. Xu, F. Yang, X.-
-
Wang, C. Wu, L. Chen, Y.-W. Liu, B. Liu, J. Yang, X.-R. Wang, J. Dong, L. Li, C.-
-
Huang, J.-P. Zhao, Y. Hu, Z.-S. Cheng, L.-L. Liu, Z.-H. Qian, C. Qin, Q. Jin, B. Cao,
J.-W. Wang, Identification of a novel coronavirus causing severe pneumonia in
human: a descriptive study, Chin. Med. J. (2020), https://doi.org/10.1097/CM9.
0000000000000722 Epub ahead of print.
[13] R. Channappanavar, S. Perlman, Pathogenic human coronavirus infections: causes
and consequences of cytokine storm and immunopathology, Semin. Immunopathol.
39 (2017) 529–539, https://doi.org/10.1007/s00281-017-0629-x.
[14] C.Y. Cheung, L.L.M. Poon, I.H.Y. Ng, W. Luk, S.-F. Sia, M.H.S. Wu, K.-H. Chan, K.-
-
Yuen, S. Gordon, Y. Guan, J.S.M. Peiris, Cytokine responses in severe acute respiratory
syndrome coronavirus-infected macrophages in vitro: possible relevance
to pathogenesis, J. Virol. 79 (2005) 7819–7826, https://doi.org/10.1128/JVI.79.
12.7819-7826.2005.
[15] H.K.W. Law, C.Y. Cheung, H.Y. Ng, S.F. Sia, Y.O. Chan, W. Luk, J.M. Nicholls,
J.S.M. Peiris, Y.L. Lau, Chemokine up-regulation in SARS-coronavirus-infected,
monocyte-derived human dendritic cells, Blood 106 (2005) 2366–2374, https://
doi.org/10.1182/blood-2004-10-4166.
[16] H. Chu, J. Zhou, B.H.-Y. Wong, C.C. Li, J.F.-W. Chan, Z.-S. Cheng, D. Yang, D. Wang,
A.C.-Y. Lee, C.C. Li, M.-L. Yeung, J.-P. Cai, I.H.-Y. Chan, W.-K. Ho, K.K.-W. To, B.-
-
Zheng, Y. Yao, C. Qin, K.-Y. Yuen, Middle east respiratory syndrome coronavirus
efficiently infects human primary T lymphocytes and activates the extrinsic and
intrinsic apoptosis pathways, J. Infect. Dis. 213 (2016) 904–914, https://doi.org/
10.1093/infdis/jiv380.
[17] A.R. Fehr, R. Channappanavar, G. Jankevicius, C. Fett, J. Zhao, J. Athmer,
D.K. Meyerholz, I. Ahel, S. Perlman, The conserved coronavirus macrodomain
promotes virulence and suppresses the innate immune response during severe acute
respiratory syndrome coronavirus infection, MBio 7 (2016), https://doi.org/10.
1128/mBio.01721-16.
[18] J.-Y. Chien, P.-R. Hsueh, W.-C. Cheng, C.-J. Yu, P.-C. Yang, Temporal changes in
cytokine/chemokine profiles and pulmonary involvement in severe acute respiratory
syndrome, Respirology (Carlton, Vic.) 11 (2006) 715–722, https://doi.
org/10.1111/j.1440-1843.2006.00942.x.
[19] R. Channappanavar, A.R. Fehr, R. Vijay, M. Mack, J. Zhao, D.K. Meyerholz,
-
Perlman, Dysregulated type I interferon and inflammatory monocyte-macrophage
responses cause lethal pneumonia in SARS-CoV-infected mice, Cell Host
Microbe 19 (2016) 181–193, https://doi.org/10.1016/j.chom.2016.01.007.
[20] S.L. Smits, A. de Lang, J.M.A. van den Brand, L.M. Leijten, W.F. van IJcken,
M.J.C. Eijkemans, G. van Amerongen, T. Kuiken, A.C. Andeweg,
A.D.M.E. Osterhaus, B.L. Haagmans, Exacerbated innate host response to SARS-CoV
in aged non-human primates, PLoS Pathog. 6 (2010) e1000756–e1000756, ,
https://doi.org/10.1371/journal.ppat.1000756.
[21] A. Junaid, H. Tang, A. van Reeuwijk, Y. Abouleila, P. Wuelfroth, V. van Duinen,
-
Stam, A.J. van Zonneveld, T. Hankemeier, A. Mashaghi, Ebola hemorrhagic
shock syndrome-on-a-chip, IScience 23 (2020) 100765, , https://doi.org/10.1016/j.
isci.2019.100765.
[22] J.A. Boga, A. Coto-Montes, S.A. Rosales-Corral, D.-X. Tan, R.J. Reiter, Beneficial
actions of melatonin in the management of viral infections: a new use for this
“molecular handyman”? Rev. Med. Virol. 22 (2012) 323–338, https://doi.org/10.
1002/rmv.1714.
[23] G. Anderson, M. Maes, R.P. Markus, M. Rodriguez, Ebola virus: melatonin as a
readily available treatment option, J. Med. Virol. 87 (2015) 537–543, https://doi.
org/10.1002/jmv.24130.
[24] R.J. Reiter, Q. Ma, R. Sharma, Melatonin in mitochondria: mitigating clear and
present dangers, Physiology (Bethesda) 35 (2020) 86–95, https://doi.org/10.1152/
physiol.00034.2019.
[25] D. Ben-Nathan, G.J. Maestroni, S. Lustig, A. Conti, Protective effects of melatonin in
mice infected with encephalitis viruses, Arch. Virol. 140 (1995) 223–230, https://
doi.org/10.1007/bf01309858.
[26] R. Hardeland, Melatonin and inflammation-story of a double-edged blade, J. Pineal
Res. 65 (2018) e12525, https://doi.org/10.1111/jpi.12525.
[27] Q.-L. Wang, L. Yang, Y. Peng, M. Gao, M.-S. Yang, W. Xing, X.-Z. Xiao, Ginsenoside
Rg1 regulates SIRT1 to ameliorate sepsis-induced lung inflammation and injury via
inhibiting endoplasmic reticulum stress and inflammation, Mediat. Inflamm. 2019
(2019) 6453296, https://doi.org/10.1155/2019/6453296.
[28] C.-K. Sun, F.-Y. Lee, Y.-H. Kao, H.-J. Chiang, P.-H. Sung, T.-H. Tsai, Y.-C. Lin, S. Leu,
Y.-C. Wu, H.-I. Lu, Y.-L. Chen, S.-Y. Chung, H.-L. Su, H.-K. Yip, Systemic combined
melatonin-mitochondria treatment improves acute respiratory distress syndrome in
the rat, J. Pineal Res. 58 (2015) 137–150, https://doi.org/10.1111/jpi.12199.
[29] Y. Ling, Z.-Z. Li, J.-F. Zhang, X.-W. Zheng, Z.-Q. Lei, R.-Y. Chen, J.-H. Feng,
MicroRNA-494 inhibition alleviates acute lung injury through Nrf2 signaling
pathway via NQO1 in sepsis-associated acute respiratory distress syndrome, Life
Sci. 210 (2018) 1–8, https://doi.org/10.1016/j.lfs.2018.08.037.
[30] A.M. da C. Pedrosa, R. Weinlich, G.P. Mognol, B.K. Robbs, J.P. de B. Viola,
-
Campa, G.P. Amarante-Mendes, Melatonin protects CD4+ T cells from activation-
induced cell death by blocking NFAT-mediated CD95 ligand upregulation, J.
Immunol (Baltimore, Md.: 1950) 184 (2010) 3487–3494, https://doi.org/10.4049/
jimmunol.0902961.
[31] Y. Shang, S.-P. Xu, Y. Wu, Y.-X. Jiang, Z.-Y. Wu, S.-Y. Yuan, S.-L. Yao, Melatonin
reduces acute lung injury in endotoxemic rats, Chin. Med. J. 122 (2009)
1388–1393.
[32] Z. Ahmadi, M. Ashrafizadeh, Melatonin as a potential modulator of Nrf2, Fund.
Clin. Pharmacol. 34 (2020) 11–19, https://doi.org/10.1111/fcp.12498.
[33] S. Habtemariam, M. Daglia, A. Sureda, Z. Selamoglu, M.F. Gulhan, S.M. Nabavi,
Melatonin and respiratory diseases: a review, Curr. Top. Med. Chem. 17 (2017)
467–488, https://doi.org/10.2174/1568026616666160824120338.
[34] R. Hardeland, Aging, melatonin, and the pro- and anti-inflammatory networks, Int.
-
Mol. Sci. 20 (2019), https://doi.org/10.3390/ijms20051223.
[35] L. Carrascal, P. Nunez-Abades, A. Ayala, M. Cano, Role of melatonin in the inflammatory
process and its therapeutic potential, Curr. Pharm. Design. 24 (2018)
1563–1588, https://doi.org/10.2174/1381612824666180426112832.
[36] Y. Imai, K. Kuba, G.G. Neely, R. Yaghubian-Malhami, T. Perkmann, G. van Loo,
-
Ermolaeva, R. Veldhuizen, Y.H.C. Leung, H. Wang, H. Liu, Y. Sun, M. Pasparakis,
-
Kopf, C. Mech, S. Bavari, J.S.M. Peiris, A.S. Slutsky, S. Akira, M. Hultqvist,
-
Holmdahl, J. Nicholls, C. Jiang, C.J. Binder, J.M. Penninger, Identification of
oxidative stress and Toll-like receptor 4 signaling as a key pathway of acute lung
injury, Cell 133 (2008) 235–249, https://doi.org/10.1016/j.cell.2008.02.043.
[37] Y. Zhao, H. Wang, W. Chen, L. Chen, D. Liu, X. Wang, X. Wang, Melatonin attenuates
white matter damage after focal brain ischemia in rats by regulating the
TLR4/NF-kappaB pathway, Brain Res. Bull. 150 (2019) 168–178, https://doi.org/
10.1016/j.brainresbull.2019.05.019.
[38] J. Luo, J. Song, H. Zhang, F. Zhang, H. Liu, L. Li, Z. Zhang, L. Chen, M. Zhang,
-
Lin, M. Lin, R. Zhou, Melatonin mediated Foxp3-downregulation decreases cytokines
production via the TLR2 and TLR4 pathways in H. pylori infected mice, Int.
Immunopharmacol. 64 (2018) 116–122, https://doi.org/10.1016/j.intimp.2018.
08.034.
[39] T.-Y. Renn, Y.-K. Huang, S.-W. Feng, H.-W. Wang, W.-F. Lee, C.-T. Lin, T. Burnouf,
L.-Y. Chen, P.-F. Kao, H.-M. Chang, Prophylactic supplement with melatonin successfully
suppresses the pathogenesis of periodontitis through normalizing RANKL/
OPG ratio and depressing the TLR4/MyD88 signaling pathway, J. Pineal Res. 64
(2018), https://doi.org/10.1111/jpi.12464.
[40] H.-H. Chen, C.-L. Chang, K.-C. Lin, P.-H. Sung, H.-T. Chai, Y.-Y. Zhen, Y.-C. Chen,
Y.-C. Wu, S. Leu, T.-H. Tsai, C.-H. Chen, H.-W. Chang, H.-K. Yip, Melatonin augments
apoptotic adipose-derived mesenchymal stem cell treatment against sepsisinduced
acute lung injury, Am. J. Transl. Res. 6 (2014) 439–458.
[41] M.-L. Wang, C.-H. Wei, W.-D. Wang, J.-S. Wang, J. Zhang, J.-J. Wang, Melatonin
attenuates lung ischaemia-reperfusion injury via inhibition of oxidative stress and
inflammation, Interact. Cardiov. Th. 26 (2018) 761–767, https://doi.org/10.1093/
icvts/ivx440.
[42] D.Y. Tamura, E.E. Moore, D.A. Partrick, J.L. Johnson, P.J. Offner, C.C. Silliman,
Acute hypoxemia in humans enhances the neutrophil inflammatory response, Shock
(Augusta, Ga.) 17 (2002) 269–273, https://doi.org/10.1097/00024382-
200204000-00005.
[43] J.V. Sarma, P.A. Ward, Oxidants and redox signaling in acute lung injury, Compr.
Physiol. 1 (2011) 1365–1381, https://doi.org/10.1002/cphy.c100068.
[44] E. Gitto, R.J. Reiter, G. Sabatino, G. Buonocore, C. Romeo, P. Gitto, C. Buggé,
-
Trimarchi, I. Barberi, Correlation among cytokines, bronchopulmonary dysplasia
and modality of ventilation in preterm newborns: improvement with melatonin
treatment, J. Pineal Res. 39 (2005) 287–293, https://doi.org/10.1111/j.1600-
079X.2005.00251.x.
[45] E. Gitto, R.J. Reiter, S.P. Cordaro, R.M. La, P. Chiurazzi, G. Trimarchi, P. Gitto,
M.P. Calabrò, I. Barberi, Oxidative and inflammatory parameters in respiratory
distress syndrome of preterm newborns: beneficial effects of melatonin, Am. J.
Perinatol. 21 (2004) 209–216, https://doi.org/10.1055/s-2004-828610.
[46] M.C. Rogers, J.V. Williams, Quis Custodiet Ipsos Custodes? Regulation of cellmediated
immune responses following viral lung infections, Annu. Rev. Virol. 5
(2018) 363–383, https://doi.org/10.1146/annurev-virology-092917-043515.
[47] C.-Y. Yang, C.-S. Chen, G.-T. Yiang, Y.-L. Cheng, S.-B. Yong, M.-Y. Wu, C.-J. Li, New
insights into the immune molecular regulation of the pathogenesis of acute respiratory
distress syndrome, Int. J. Mol. Sci. 19 (2018), https://doi.org/10.3390/
ijms19020588.
[48] Y. Liu, Y. Yang, C. Zhang, F. Huang, F. Wang, J. Yuan, Z. Wang, J. Li, J. Li, C. Feng,
-
Zhang, L. Wang, L. Peng, L. Chen, Y. Qin, D. Zhao, S. Tan, L. Yin, J. Xu, C. Zhou,
-
Jiang, L. Liu, Clinical and biochemical indexes from 2019-nCoV infected patients
linked to viral loads and lung injury, Sci. China Life Sci. (2020), https://doi.org/10.
1007/s11427-020-1643-8.
[49] S.C. Miller, S.R. Pandi-Perumal, A.I. Esquifino, D.P. Cardinali, G.J.M. Maestroni,
The role of melatonin in immuno-enhancement: potential application in cancer, Int.
-
Exp. Pathol. 87 (2006) 81–87, https://doi.org/10.1111/j.0959-9673.2006.
00474.x.
[50] C. Kaur, E.A. Ling, Effects of melatonin on macrophages/microglia in postnatal rat
brain, J. Pineal Res. 26 (1999) 158–168, https://doi.org/10.1111/j.1600-079x.
1999.tb00578.x.
[51] M.D. Tate, J.D.H. Ong, J.K. Dowling, J.L. McAuley, A.B. Robertson, E. Latz,
G.R. Drummond, M.A. Cooper, P.J. Hertzog, A. Mansell, Reassessing the role of the
NLRP3 inflammasome during pathogenic influenza a virus infection via temporal
inhibition, Sci. Rep. 6 (2016) 27912, https://doi.org/10.1038/srep27912.
[52] C. Shen, Z. Zhang, T. Xie, J. Ji, J. Xu, L. Lin, J. Yan, A. Kang, Q. Dai, Y. Dong,
-
Shan, S. Wang, X. Zhao, Rhein suppresses lung inflammatory injury induced by
human respiratory syncytial virus through inhibiting NLRP3 inflammasome activation
via NF-kappaB pathway in mice, Front. Pharmacol. 10 (2019) 1600, https://
doi.org/10.3389/fphar.2019.01600.
R.
[53] S.H.J. Mei, S.D. McCarter, Y. Deng, C.H. Parker, W.C. Liles, D.J. Stewart, Prevention
of LPS-induced acute lung injury in mice by mesenchymal stem cells overexpressing
angiopoietin 1, PLoS Med. 4 (2007) e269, https://doi.org/10.1371/journal.pmed.
0040269.
[54] H.-M. Wu, Q.-M. Xie, C.-C. Zhao, J. Xu, X.-Y. Fan, G.-H. Fei, Melatonin biosynthesis
restored by CpG oligodeoxynucleotides attenuates allergic airway inflammation via
regulating NLRP3 inflammasome, Life Sci. 239 (2019) 117067, https://doi.org/10.
1016/j.lfs.2019.117067.
[55] Y. Zhang, X.X. Li, J.J. Grailer, N. Wang, M. Wang, J. Yao, R. Zhong, G.F. Gao,
P.A. Ward, D.-X. Tan, X.X. Li, Melatonin alleviates acute lung injury through inhibiting
the NLRP3 inflammasome, J. Pineal Res. 60 (2016) 405–414, https://doi.
org/10.1111/jpi.12322.
[56] H. Bazyar, H. Gholinezhad, L. Moradi, P. Salehi, F. Abadi, M. Ravanbakhsh, A. Zare
Javid, The effects of melatonin supplementation in adjunct with non-surgical periodontal
therapy on periodontal status, serum melatonin and inflammatory markers
in type 2 diabetes mellitus patients with chronic periodontitis: a double-blind,
placebo-controlled trial, Inflammopharmacology 27 (2019) 67–76, https://doi.org/
10.1007/s10787-018-0539-0.
[57] A.L. Sanchez-Lopez, G.G. Ortiz, F.P. Pacheco-Moises, M.A. Mireles-Ramirez,
O.K. Bitzer-Quintero, D.L.C. Delgado-Lara, L.J. Ramirez-Jirano, I.E. Velazquez-
Brizuela, Efficacy of melatonin on serum pro-inflammatory cytokines and oxidative
stress markers in relapsing remitting multiple sclerosis, Arch. Med. Res. 49 (2018)
391–398, https://doi.org/10.1016/j.arcmed.2018.12.004.
[58] B. Kucukakin, J. Lykkesfeldt, H.J. Nielsen, R.J. Reiter, J. Rosenberg, I. Gogenur,
Utility of melatonin to treat surgical stress after major vascular surgery–a safety
study, J. Pineal Res. 44 (2008) 426–431, https://doi.org/10.1111/j.1600-079X.
2007.00545.x.
[59] Z. Zhao, C. Lu, T. Li, W. Wang, W. Ye, R. Zeng, L. Ni, Z. Lai, X. Wang, C. Liu, The
protective effect of melatonin on brain ischemia and reperfusion in rats and humans:
in vivo assessment and a randomized controlled trial, J. Pineal Res. 65 (2018)
e12521, https://doi.org/10.1111/jpi.12521.
[60] E. Shafiei, M. Bahtoei, P. Raj, A. Ostovar, D. Iranpour, S. Akbarzadeh, H. Shahryari,
-
Anvaripour, R. Tahmasebi, T. Netticadan, A. Movahed, Effects of N-acetyl cysteine
and melatonin on early reperfusion injury in patients undergoing coronary
artery bypass grafting: a randomized, open-labeled, placebo-controlled trial,
Medicine. 97 (2018) e11383, https://doi.org/10.1097/MD.0000000000011383.
[61] M. Zarezadeh, M. Khorshidi, M. Emami, P. Janmohammadi, H. Kord-Varkaneh,
S.M. Mousavi, S.H. Mohammed, A. Saedisomeolia, S. Alizadeh, Melatonin supplementation
and pro-inflammatory mediators: a systematic review and meta-analysis
of clinical trials, Eur. J. Nutr. (2019), https://doi.org/10.1007/s00394-019-02123-
0 [Epub ahead of print].
[62] J. Cheng, H.-L. Yang, C.-J. Gu, Y.-K. Liu, J. Shao, R. Zhu, Y.-Y. He, X.-Y. Zhu, M.-
-
Li, Melatonin restricts the viability and angiogenesis of vascular endothelial cells
by suppressing HIF-1alpha/ROS/VEGF, Int. J. Mol. Med. 43 (2019) 945–955,
https://doi.org/10.3892/ijmm.2018.4021.
[63] H. Volt, J.A. Garcia, C. Doerrier, M.E. Diaz-Casado, A. Guerra-Librero, L.C. Lopez,
-
Escames, J.A. Tresguerres, D. Acuna-Castroviejo, Same molecule but different
expression: aging and sepsis trigger NLRP3 inflammasome activation, a target of
melatonin, J. Pineal Res. 60 (2016) 193–205, https://doi.org/10.1111/jpi.12303.
[64] W. Dai, H. Huang, L. Si, S. Hu, L. Zhou, L. Xu, Y. Deng, Melatonin prevents sepsisinduced
renal injury via the PINK1/Parkin1 signaling pathway, Int. J. Mol. Med. 44
(2019) 1197–1204, https://doi.org/10.3892/ijmm.2019.4306.
[65] J. Zhang, L. Wang, W. Xie, S. Hu, H. Zhou, P. Zhu, H. Zhu, Melatonin attenuates ER
stress and mitochondrial damage in septic cardiomyopathy: a new mechanism involving
BAP31 upregulation and MAPK-ERK pathway, J. Cell. Physiol. 235 (2020)
2847–2856, https://doi.org/10.1002/jcp.29190.
[66] J. Chen, H. Xia, L. Zhang, H. Zhang, D. Wang, X. Tao, Protective effects of melatonin
on sepsis-induced liver injury and dysregulation of gluconeogenesis in rats through
activating SIRT1/STAT3 pathway, Biomed. Pharmacother. 117 (2019) 109150,
https://doi.org/10.1016/j.biopha.2019.109150.
[67] F. Nduhirabandi, K. Lamont, Z. Albertyn, L.H. Opie, S. Lecour, Role of toll-like
receptor 4 in melatonin-induced cardioprotection, J. Pineal Res. 60 (2016) 39–47,
https://doi.org/10.1111/jpi.12286.
[68] S. Tordjman, S. Chokron, R. Delorme, A. Charrier, E. Bellissant, N. Jaafari,
-
Fougerou, Melatonin: pharmacology, functions and therapeutic benefits, Curr.
Neuropharmacol. 15 (2017) 434–443, https://doi.org/10.2174/
1570159X14666161228122115.
[69] K. Lewandowska, M.A. Malkiewicz, M. Sieminski, W.J. Cubala, P.J. Winklewski,
W.A. Medrzycka-Dabrowska, The role of melatonin and melatonin receptor agonist
in the prevention of sleep disturbances and delirium in intensive care unit — a
clinical review, Sleep Med. 69 (2020) 127–134, https://doi.org/10.1016/j.sleep.
2020.01.019.
[70] G. Mistraletti, M. Umbrello, G. Sabbatini, S. Miori, M. Taverna, B. Cerri,
E.S. Mantovani, P. Formenti, P. Spanu, A. D’Agostino, S. Salini, A. Morabito,
-
Fraschini, R.J. Reiter, G. Iapichino, Melatonin reduces the need for sedation in
ICU patients: a randomized controlled trial, Minerva Anestesiol. 81 (2015)
1298–1310.
[71] S.R. Lewis, M.W. Pritchard, O.J. Schofield-Robinson, P. Alderson, A.F. Smith,
Melatonin for the promotion of sleep in adults in the intensive care unit, The
Cochrane Database of Syst. Rev. 5 (2018) CD012455, https://doi.org/10.1002/
14651858.CD012455.pub2.
[72] L.P.H. Andersen, I. Gogenur, J. Rosenberg, R.J. Reiter, The safety of melatonin in
humans, Clin. Drug Investig. 36 (2016) 169–175, https://doi.org/10.1007/s40261-
015-0368-5.
[73] R.S. Bourne, G.H. Mills, C. Minelli, Melatonin therapy to improve nocturnal sleep in
critically ill patients: encouraging results from a small randomised controlled trial,
Crit. Care (London, England). 12 (2008) R52, https://doi.org/10.1186/cc6871.
[74] G. Mistraletti, G. Sabbatini, M. Taverna, M.A. Figini, M. Umbrello, P. Magni,
-
Ruscica, E. Dozio, R. Esposti, G. DeMartini, F. Fraschini, R. Rezzani, R.J. Reiter,
-
Iapichino, Pharmacokinetics of orally administered melatonin in critically ill
patients, J. Pineal Res. 48 (2010) 142–147, https://doi.org/10.1111/j.1600-079X.
2009.00737.x.
[75] J.J. Nordlund, A.B. Lerner, The effects of oral melatonin on skin color and on the
release of pituitary hormones, J. Clin. Endocrinol. Metab. 45 (1977) 768–774,
https://doi.org/10.1210/jcem-45-4-768.
-
Zhang, et al. Life Sciences 250 (2020) 117583




