Вопрос исследования свойств пептидов и их практического применения сейчас очень актуален [Dudgeon W. D. et al., 2016]. Это вещества, которые действуют подобно белкам, однако имеют меньший размер молекул и более высокую эффективность. Они образуются в процессе естественных биохимических обменных реакций. IPH REG – короткий пептид, который не распознается в крови, поэтому исследование его свойств в клинических испытаниях осуществлялось на культурах клеток.
У пептида IPH REG выявили выраженные антиоксидантные и репаративные свойства, которые реализуются благодаря возможности исправлять проблемы с ДНК. Соединение взаимодействует с рецепторами и активирует процесс обновления клеток и их пролиферацию. Такое преимущество, как регулирование клеточной активности, вызывает интерес и создает подоплеку для поиска лекарственных препаратов на основе пептида IPH REG.
Исследование проводилось для выявления антиоксидантных и регенерирующих свойств пептида.
Клиническое изучение регенерирующих свойств пептида
В ходе исследования изучалась эффективность доз пептида в 50, 100 и 150 мкг. Выборка людей для каждой дозы составляла 76 человек с возрастным интервалом 25–60 лет. Молодой и средний возраст был выбран с расчетом пользы практического применения результатов исследования, а именно возможности составления профилактических программ на основе IPH REG как регенератора тканей и антиоксиданта. Эффективность соединения оценивалась сначала до проведения исследования, а затем дважды в ходе использования короткого пептида IPH REG: через 3 и 6 месяцев.
На первом этапе исследования изучалось изменение экспрессии молекулярных маркеров пролиферации (Sir2) и белков p16INK4a для определения способности к регенерации на фоне приема IPH REG.
Следующим этапом было изучение активности антиоксидантной системы после приема пептида.
Результаты исследования
Данные о влиянии пептида IPH REG на маркеры пролиферации и показательные белки приведены в таблице 1.
Таблица 1 – Динамика экспрессии молекулярных маркеров сиртуинов Sir2 и p16INK4a при применении пептида IPH REG

* p < 0,05 – разница до начала исследования с контрольной группой;
** p < 0,05 – разница через 3 и 6 месяцев;
# p < 0,05 – разница между дозировками 50 мкг и 100 мкг.
В ходе исследования выявили, что пептид IPH REG способствует увеличению экспрессии Sir2 в 1,7 раз через 3 месяца применения и в 2,5 раза через 6 месяцев. Это подтверждает высокую активность пептида в качестве регенератора тканей и его пользу в устранении повреждений ДНК.
Была выявлена эффективная оптимальная дозировка – 100 мкг.
При изучении влияния пептида на активность белка p16INK4a получены данные, представленные в таблице 1. Они позволили предположить высокую антиоксидантную активность пептида IPH REG, что и было изучено путем составления кривой динамики экспрессии мРНК (рисунок 1).
Рисунок 1
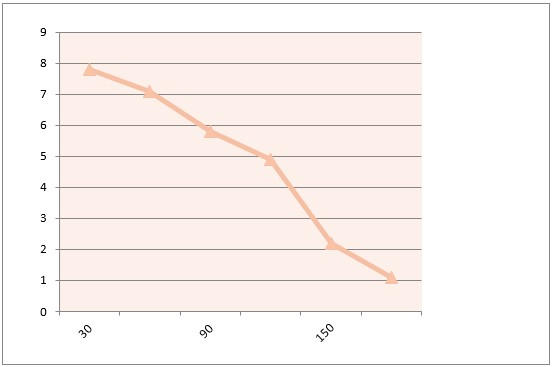
Ось X –сутки.
Ось Y – площадь экспрессии мРНК p16INK4a (%).
Снижение площади экспрессии белка подтверждает антиоксидантное действие изучаемого пептида.
Влияние применения пептида IPH REG на прооксидантный и антиоксидантный статус
Данные изучения антиоксидантного статуса пациентов приведены в таблице 2.
Таблица 2 – Параметры прооксидантного и антиоксидантного статуса (M ± m)
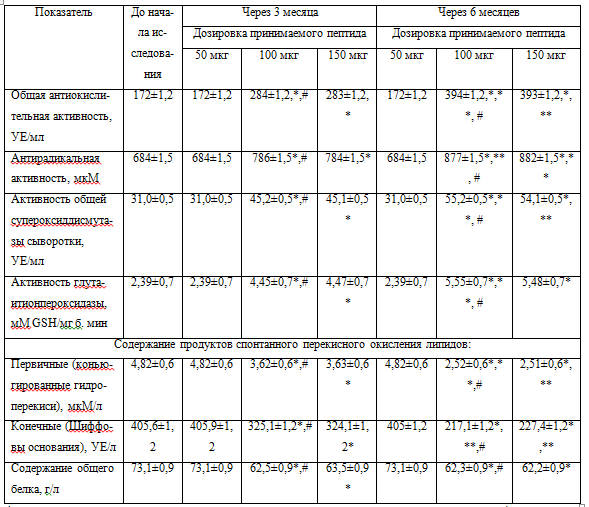
* p < 0,05 – разница с контрольной группой до проведения анализа;
** p < 0,05 – разница через 3 и 6 месяцев;
# p < 0,05 – разница дозировок 50 и 100 мкг.
Эффективной дозировкой оказалось количество в 100 мкг, которое показало усиление работы антиоксидантной системы и снижение уровня свободных радикалов.
Эксперимент
В эксперименте изучались регенерирующие и антиоксидантные свойства пептида IPH REG на крысах, организм которых максимально приближен к человеческому по фармакокинетическим параметрам. Все манипуляции с животными и условия их содержания соответствовали стандартам ISO 10993-1-2003 и ГОСТ РИСО 10993.2-2006.
В эксперименте принимали участие 60 крыс, которым создали условия оксидативного стресса, что приводит к повреждению клеток и нарушению процессов репарации. Дополнительно осуществили механические повреждения кожных покровов (после обработки спиртом делали рану на спине диаметром 1 см), чтобы оценить регенеративные свойства пептида.
Животных разделили на контрольную и основную группы. Основной группе перорально вводили жидкость, в которой был растворен порошок пептида IPH REG(концентрация пересчитывалась на массу тела). Через 30 суток крыс умертвили, а из участка раны изготавливали срезы, которые изучали под микроскопом. Материал окрашивали, чтобы оценить экспрессию PCNA – ядерного антигена пролиферирующих клеток, по уровню которого можно оценить процесс регенерации. Результат указывали в % окрашенных клеток к общему числу.
Результат показал, что использование IPH REG снизило экспрессию PCNA по сравнению с контрольной группой, где процессы репаративной регенерации не были завершены, в отличие от биоматериала основной группы (рисунок 2).
Рисунок 2 – Экспрессия PCNA. Окраска гематоксилином и эозином
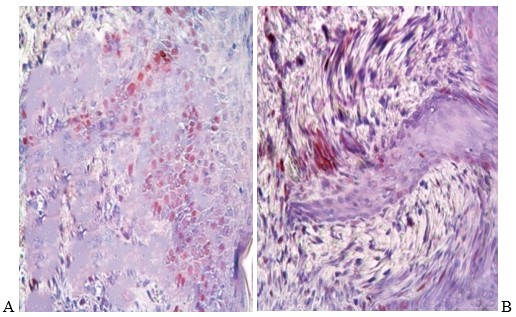
А – пептид IPH REG не использовался.
В – основная группа.
В результате выяснилось, что пептид действительно способен усиливать регенерацию тканей после их механического повреждения.
Белок Ki 67 является известным маркером пролиферации клеток. Снижение повышенной экспрессии белка Ki 67, которая развивается на фоне оксидативного стресса, свидетельствует о наличии антиоксидативного эффекта и высокой регенеративной способности.
В ходе проведенного эксперимента нами было обнаружено, что при употреблении добавки IPH REG экспрессия соединения Ki 67 снижается в 1,6 раз в сравнении с результатами без использования пептида (рисунок 3).
Рисунок 3
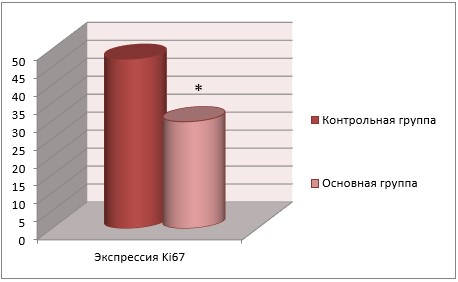
* p < 0,05 по сравнению с контрольной группой.
Таким образом, пептид IPH REG оказывается эффективен для обновления тканей и снижения количества свободных радикалов при развитии оксидативного стресса и механического повреждения на экспериментальной модели у крыс.
Анализ соединения IPH REG в клеточных культурах
Пептид изменяет клеточную активность в сторону активации регенерирующих процессов. Его репаративные и антиоксидантные свойства были изучены на клеточных культурах.
В качестве материала исследования применяли стволовые клетки эмбриона. В качестве показательных молекул-маркеров были выбраны:
- интерфероны. Белки, которые организм выделяет при вирусном заражении;
- CD90. Маркер стволовых клеток, который регулирует их дифференцировку и обновление;
- P16 (INK4a). При гиперэкспрессии этого гена гибель клеток преобладает над их пролиферативной способностью, что расценивается как признак повреждения [Sharpless N. E., 2004];
- белок p53. Его концентрация повышается при повреждениях ДНК [Arshad H. et al., 2010].
Повышенная экспрессия вышеуказанных маркеров подтверждает репаративный эффект исследуемого соединения IPH REG и его способность уменьшать количество вредных свободных радикалов. Его клиническая активность изучалась на следующих культурах:
- SC5-MSC стволовые клетки эмбриона;
- свойства CD 90 изучались на амнионе человека.
Опытные группы:
- Активность исследуемых молекул оценили до начала опыта.
- Контроль.
- Для получения контрольного результата добавили дипептид Glu-Trp в аналогичном количестве 100 мкг.
- Добавили исследуемый пептид IPH REG (100 мкг).
Пептиды брали в порошкованном виде. Оптимальной дозировкой определили 100 мкг/мл [Линькова Н. С. и др., 2016; Khavinson V. et al., 2017].
Для контроля было взято иммунопротекторное соединение Glu-Trp. Его свойства уже были изучены и описаны в литературе [Морозов В. Г., Хавинсон В. Х., Малинин В. В., 2000; Хавинсон В. Х., Морозов В. Г., 2001; Хавинсон В. Х., Кузник Б. И., Линькова Н. С., Проняева В. Е., 2013].
Препараты изучали с использованием микроскопа при разных увеличениях. Измеряли относительную площадь экспрессии в %. Область исследуемого маркера подсвечивалась синим. Результаты приведены на рисунке 4, где видно, что пептид потенцирует продукцию интерферона и проявляет антиоксидантные свойства.
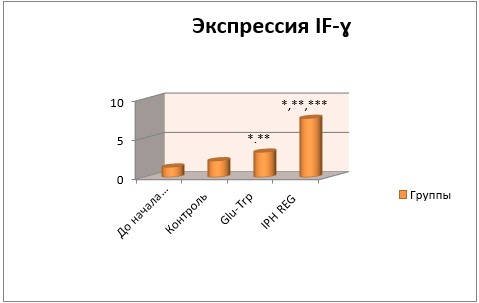
Рисунок 4 – Воздействие IPH REG на экспрессию IF-γ
* p < 0,05 – разница полученных и исходных значений;
** p < 0,05 – разница результатов с контролем;
*** p < 0,05 – разница показателей контрольного и исследуемого пептида.
При изучении воздействия IPH REG на экспрессию CD90 была выявлена увеличенная выработка последнего, что дает основания предполагать противоопухолевый эффект исследуемого соединения (рисунок 5).
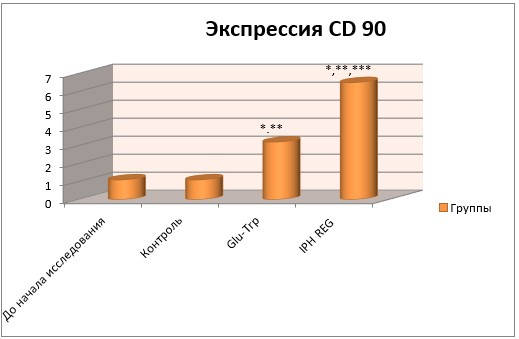
Рисунок 5 – Воздействие IPH REG на преобразование CD90
* p < 0,05 – сравнение с первоначальными значениями;
** p < 0,05 – разница с результатами контроля;
*** p < 0,05 – разница результатов Glu-Trp и IPH REG.
В свою очередь, выявилась повышенная выработка P16 (INK4a), что привело к усилению восстановления нормальной активности клеток (рисунок 6).
Рисунок 6 – Действие IPH REG на преобразование INK-ATTAC
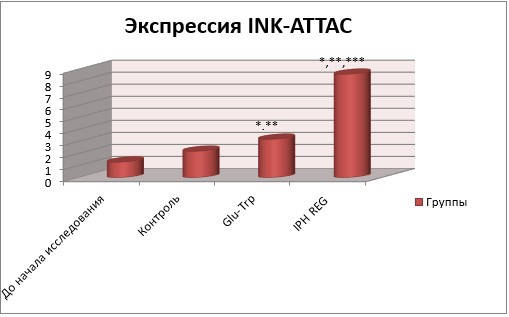
* p < 0,05 – разница с первоначальными данными;
** p < 0,05 – сравнение с результатами контроля;
*** p < 0,05 – разница показателей при использовании Glu-Trp и короткого пептида IPH REG.
Повышая синтез белка p53, пептид IPH REG проявляет супрессорные и репаративные свойства.
Общий итог
Таким образом, применение короткого пептида IPH REG в дозировке 100 мкг обеспечивает эффективную антиоксидантную и прооксидантную защиту организма, нормализуя параметры уже через 3 месяца применения.
Полученные результаты исследований свидетельствуют о высокой активности пептида IPH REG как регенератора тканей после механического повреждения. После его использования в ходе исследования фиксировалась завершенная репаративная регенерация.
Антиоксидантные и регенерирующие свойства были доказаны на разных исследуемых материалах. Рекомендовано применение пептида IPH REG в качестве регенератора тканей и антиоксиданта.
Литература
- Морозов В. Г., Хавинсон В. Х., Малинин В. В. Пептидные тимомиметики. СПб.: Наука, 2000. 157 с.
- Хавинсон В. Х., Кузник Б. И., Линькова Н. С., Проняева В. Е. Влияние пептидных регуляторов и цитокинов на продолжительность жизни и возрастные изменения системы гемостаза. // Успехи физиол. наук. 2013. Т. 44. № 1. С. 39–53.
- Хавинсон В. Х., Морозов В. Г. Пептиды эпифиза и тимуса в регуляции старения. СПб., Фолиант, 2001. 159 с.
- Lin L, Achermann JC. Steroidogenic factor-1 (SF-1, Ad4BP, NR5A1) and disorders of testis development // Sex Dev. – 2008; 2 (4–5): 200–209.
- Sivasubramaniyan K, Harichandan A, Schilbach K. Expression of stage-specific embryonic antigen-4 (SSEA-4) defines spontaneous loss of epithelial phenotype in human solid tumor cells // Glycobiology-2015 Aug; 25 (8): 902–17.
- Миронов А. Н., Бунатян Н. Д. и др. Руководство по проведению доклинических исследований лекарственных средств // Коллектив авторов. — М.: Гриф и К, 2012. — 944 с.




