В настоящее время большой интерес представляет изучение свойств пептидов биологических процессов. Пептиды имеют ту же структуру, что и белки (протеины), но размер этих молекул меньше. Важно также отметить, что короткие пептиды, являясь естественным продуктом обмена веществ, присутствующих в организме, не могут быть выявлены в крови или моче. В связи с этим интерес представляет изучение свойств отдельных структур на клеточных культурах.
Пептид IPH REG обладает регенерирующим, антиоксидантным и репаративным действием, которое обусловлено способностью к исправлению повреждений ДНК. Пептид IPH REG способен регулировать клеточную активность, взаимодействуя со специфическими рецепторами. Они активируют определенные гены, участвующие в процессе обновления внеклеточной матрицы и пролиферации клеток, что обуславливает его высокую способность к регенерации клеток и тканей.
В современном научном обществе имеется большой интерес к поиску новых форм лечебно-профилактических препаратов, обладающих регенерирующим и антиоксидантным свойствами.
Таким образом, в связи с вышеперечисленным целью нашего исследования было изучение регенерирующих и антиоксидативных свойств пептида IPH REG на культуре клеток человека.
Для оценки антиоксидантных, регенерирующих и репаративных свойств пептида IPH REG нами были выбраны эмбриональные стволовые клетки (ЭСК), которые относятся к плюрипотентному типу, это значит, что они могут дифференцироваться во все три первичных зародышевых листка: эктодерму, энтодерму и мезодерму, из которых в дальнейшем образуются органы и железы репродуктивной и других систем. Эмбрион человека достигает стадии бластоцисты, из которой получают стволовые клетки, спустя 5-6 дней после оплодотворения.
Нами была проведена оценка маркерных биологических активных молекул иммунофлуоресцентным методом с использованием первичных антител к IN-γ (1:100, Abcam), CD90 (1:250, Abcam), INK-ATTAC (1:75, Abcam), белку р53 (1:50, Abcam).
Нами были выбраны следующие маркерные биологически активные молекулы:
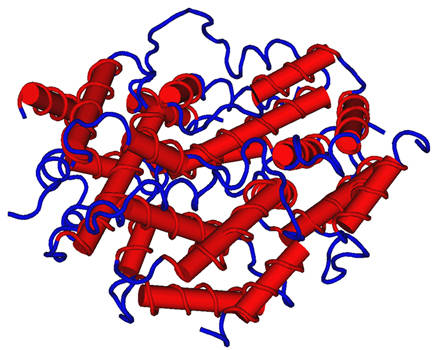
1) Интерфероны — общее название, под которым в настоящее время объединяют ряд белков со сходными свойствами, выделяемых клетками организма в ответ на вторжение вируса. Вторым направлением действия интерферонов является стимуляция иммунной системы для борьбы с вирусными агентами. Интерферон повышает синтез молекул главного комплекса гистосовместимости I и II классов и активирует иммунопротеасому. Некоторые виды интерферонов, например интерферон-γ (Рисунок 1), могут прямо стимулировать клетки иммунной системы, такие как макрофаги и натуральные киллеры.
Рисунок 1. Схематическое строение интерферона гамма.
2) Уровень экспрессии поверхностных маркеров CD105, CD90, CD73, CD44 стабильно высок во всех выделяемых эмбриональных клетках, кроме линии SC5-MSC, на которой проводился эксперимент и в которой уровень экспрессии CD90 значительно ниже (около 60%). Известно, что уровень экспрессии поверхностных маркеров CD90 и CD105 связан, в частности, с процессами дифференцировки.
CD90 является маркером стволовых клеток и способствует переходу их в комитированные формы, регулируя дифференцировку клеток нейронального и стромального происхождения, оказывая, тем самым, регенерирующее действие. Кроме того, этот белок является антиапоптотическим фактором по отношению к лимфоидным клеткам, особенно Т-лимфоцитам. Снижение его экспрессии в популяции нейронов или лимфоидных клеток влечет за собой развитие нейрогенных опухолей, лимфобластозов и других новообразований. Угнетение синтеза белка CD90 также наблюдается при развитии опухолей различного генеза. Таким образом, определение уровня белка CD90 под действием изучаемого пептида было выбрано с точки зрения оценки регенерирующих свойств пептида.
3) Среди изучаемых пептидных молекул общепризнанным маркером клеточного повреждения является p16(INK4a)
Ген INK4a/ARF кодирует синтез двух белков-супрессора опухолей, p16INK4a, который является общепризнанным маркером старения и белка INK-ATTAC, реализующего свои эффекты через активацию синтеза проапоптотического транскрипционного фактора р53, который играет ключевую роль в эндогенных противоопухолевых механизмах.
Установлено, что в полипотентных клетках гиперэкспрессия транскриптов гена INK4a/ARF индуцирует преобладание процессов клеточной гибели над их способностью к пролиферации, что приводит к снижению числа малодифференцированных клеток и является характерным признаком повреждения клеток и ткани.
Baker D.J. et al. (2002) выдвинули гипотезу о том, что накопление в тканях клеток, экспрессирующих маркер p16INK4a и других сигнальных молекул, приводит к снижению пролиферативной и функциональной активности клеток, что нарушает процессы регенерации в организме. Установлено, что элиминация клеток, экспрессирующих p16INK4a с помощью белка INK-ATTAC способствует восстановлению репаративной активности клеток и реализует свои эффекты через активацию синтеза проапоптотического транскрипционного фактора р53.
По последним исследованиям (2015) было показано, что в экспериментальной модели удаление p16Ink4a-позитивных SEN-клеток с помощью белка INK-ATTAC замедляет развитие дегенеративных процессов в тканях, для которых характерно накопление этих клеток.
4) Повреждение полипотентных клеток в культуре связано с увеличением активности гена p53.
Белок p53 осуществляет контроль над течением процессов клеточного цикла, а также за отсутствием в геноме повреждений, которые могли бы привести к дальнейшему развитию патологии. Белок р53 является транскрипционным фактором, выполняющим функцию супрессора образования злокачественных опухолей путем активации апоптоза в тканях организма.
Белок р53 активируется при повреждениях ДНК, а также при стимулах, которые могут привести к подобным повреждениям или являются сигналом о нарушении функциональной активности клетки, что определяет его регенеративные свойства.
Р53-зависимый апоптоз позволяет избежать накопления мутаций, а, в случае, когда они уже возникли, p53-зависимый апоптоз позволяет элиминировать такие потенциально опасные для организма клетки, оказывая антиоксидантное действие.
Экспрессия обозначенных биологически активных молекул подтверждает регенерирующее и антиоксидатное свойство пептида IPH REG.
Материалы исследования.
Для изучения свойств пептида IPH REG нами были использованы следующие клеточные культуры Российской коллекции клеточных культур позвоночных (РККК П):
SC5-MSC
Происхождение: человек, мезенхимные стволовые клетки из эмбриональных стволовых клеток
Цитология. 2012. 54 (1): 5 – 16; Tissue Eng Part A. 2010. 16:705 – 715.
Морфология: фибробластоподобная
Способ культивирования: монослойный
Условия культивирования: среда — α-MEM сыворотка — эмбриональная бычья 10% процедура пересева — cнятие клеток, используя трипсин 0.25%: версен 0.02% (1:3), кратность рассева 1:4, оптимальная плотность 4.0 – 5.0х104 клеток/см2
криоконсервация — ростовая среда, 10% DMSO, 1.5-2.0х10 6 клеток/мл в ампуле
Жизнеспособность после криоконсервации: 90% (окраска трипановым синим на нулевом пассаже).
Контроль контаминации: бактерии, грибы и микоплазма не обнаружены
Контроль видовой идентичности: кариологический анализ.
Кариология: 2n= 46, модальное число хромосом 46 (100.0+1.0 %), нормальный кариотип человека (46, XХ), количество полиплоидов 0.9%.
ДНК профиль (STR): Amelogenin: X, X
CSF1PO: 12, 13
D13S317: 8, 11
D16S539: 9, 12
D5S818: 9, 11
D7S820: 10, 12
THO1: 6, 9.3
TPOX: 10, 11
vWA: 17,17
Другие характеристики:
Среднее время одного удвоения клеточной популяции 25.5 ч; время активной (логарифмической) фазы роста на 6-м пассаже составляет 96 ч. Линия с ограниченным сроком жизни, до 59 удвоений клеточной популяции не наблюдается снижения пролиферативной активности.
Экспрессия поверхностных антигенов, характерных для мезенхимных стволовых клеток: CD44, CD73, CD90, CD105 и HLA-ABC; отсутствие экспрессии антигенов CD34 и HLA-DR.
Направленная дифференцировка в адипогенном, остеогенном и хондрогенном направлениях.
Область применения: клеточная биология, биотехнология, фидер для культивирования эмбриональных стволовых клеток.
Рисунок 2. Культура эмбриональные стволовые клетки SC 5- MSC. Световая микроскопия, х400.
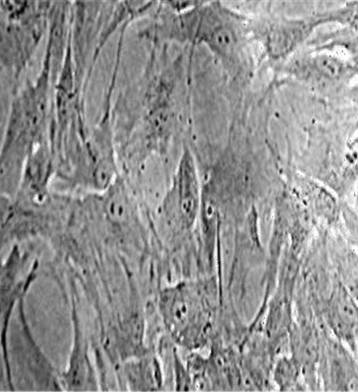
Для изучения свойств CD 90 нами был выбран амнион человека, чувствительный к данному виду молекулы:
FLv
Происхождение: человек, амнион, сублиния FL.
Proc. Soc.Exp.Biol.Med. 1957. 94: 532; Cancer Res. 1958. 18: 692; J. Natl.
Cancer Inst. 1959. 23: 893; Arch. Gesamte Virusforsch. 1960. 9: 559;
Proc.Soc.Exp.Biol.Med. 1965. 119: 223.
Морфология: эпителиоподобная
Способ культивирования: монослойный
Условия культивирования: среда — 199 или ЕМЕМ сыворотка — КРС 10% (199); эмбриональная бычья10% (ЕМЕМ) процедура пересева — cнятие клеток, используя версен 0.02% c химопсином 0.1 мг/мл, кратность рассева 1:4 -1:6, оптимальная плотность 0.5-1.0х105 клеток/мл
криоконсервация — среда 199 (70%) + КРС 20% или ЕМЕМ 80%+эмбриональная бычья сыворотка 10%, DMSO 10%, 4.0-5.0 х106 клеток/мл в ампуле
Жизнеспособность после криоконсервации: 83%(окраска трипановым синим на нулевом пассаже)
Контроль контаминации: бактерии, грибы и микоплазма не обнаружены.
Контроль видовой идентичности: кариологический и изоферментный (ЛДГ, Г6ФДГ) анализ.
Кариология: 2n=46, пределы изменчивости по числу хромосом 47-66, модальное число хромосом 60, количество маркеров 9, из которых 3 — специфичны для клеток НеLa (N 1,2,3, G диски).
Эффективность клонирования: 85% (ЕСКК – единая система классификации и кодирования).
Другие характеристики:
чувствительность к вирусам: полиовирус1; аденовирусы; Коксаки; ECHO; коровья
оспа; реовирусы; арбовирусы; риновирусы; корь; респираторно-синцитиальный
вирус, парагрипп, герпес вирусы
Изоэнзимы Г6ФДГ, А.16
Чувствительность к интерферону человека.
Присутствие онковирусов А и В (ЕСКК).
Область применения: вирусология, канцерогенез, клеточная биология.
Коллекции: Белорусская коллекция культур клеток человека и животных; НИИ вирусологии РАМН (Федеральное государственное бюджетное учреждение науки «Институт цитологии Российской академии наук)
Методы исследования
Группы для исследования:
1 группа – измерение экспрессии молекул до начала исследования,
2 группа — контроль (добавление питательной среды, инкубирование сывороточным альбумином),
3 группа – добавление контрольного пептида дипептида Glu-Trp в концентрации 100 микрограммов (мкг);
4 группа – добавление пептида IPH REG в концентрации 100 микрограммов (мкг).
Для исследования использовали пептиды IPH REG и Glu-Trp в форме лиофилизированного порошка, которые растворяли стерильной водой для инъекций в объёме 10 мл до конечной концентрации пептидов 100 мкг.
Для большинства диссоциированных клеточных культур, как было показано ранее, наиболее эффективной является концентрация пептидов 100 мкг/мл по многолетнему опыту применения пептидов.
В качестве контроля выбран иммунопротекторный пептид Glu-Trp с известными и хорошо описанными в литературе свойствами.
Для измерения уровня экспрессии генов применяли PCR-метод с использованием собственных праймеров и реагентов фирмы Novocasta и наборы моноклональных антител производства фирмы Biosource (Бельгия).
Мазки клеток обрабатывались соответствующими первичными антителами по стандартному протоколу:
1. Трехкратная промывка фосфатно-солевым буфером — ФСБ(рН=7,2) по 5 мин;
2. Пермеабилизация клеток 0,1% Triton X-100, растворенном в ФСБ, в течение 15 мин;
3. Промывка в трех сменах ФСБ (по 5 мин);
4. Инкубация в 1% бычьем сывороточном альбумине (разведенным ФСБ, pH 7,5) в течение 30 мин для блокировки неспецифического связывания;
5. Инкубация с первичными антителами, 60 мин;
6. Промывка в трех сменах ФБС (по 5 мин);
7. Инкубация со вторичными антителами, конъюгированными с флуорохромом Alexa Fluor 488 (1:1000, Abcam) 30 мин при комнатной температуре в темноте;
8. Промывка в трех сменах ФСБ по 5мин;
9. Докраска ядер клеток красителем Hoechst 33258 (Sigma, США) (1:100 от стокового раствора в dH2O) в течение 1 мин (краситель используется в качестве флуоресцентного маркера ДНК, при связывании с которой его флуоресценция усиливается).
10. Промывка в ФСБ 5 мин;
11. Заключение готовых препаратов под покровные стекла в монтирующую среду Dako Fluorescent Mounting Medium (Dako).
Изучение препаратов проводили в конфокальном микроскопе Olympus FluoView FV1000 при увеличении 200, 400, 600. Синим цветом флуоресцирует экспрессия исследуемого маркера. Проводили измерение относительной площади экспрессии в %. Относительную площадь экспрессии рассчитывали, как отношение площади, занимаемой иммунопозитивными клетками, к общей площади клеток в поле зрения и выражали в процентах. Динамика экспрессии генов измерена в условных единицах, базовый уровень принят за 10.
Результаты исследования и их обсуждение
Оценка регенерирующих и антиоксидантных специфических свойств пептида IPH REG на экспрессию биологически активных маркеров
Влияние пептида IPH REG на экспрессию IN-γ в культуре клеток человека
На рисунке 3 показано, что применение пептида IPH REG увеличивает выработку интерферона гамма, что позволяет судить о высокой антиоксидантной способности изучаемого пептида.
Рисунок 3. Влияние пептида IPH REG на экспрессию IN-γ в культуре клеток человека.
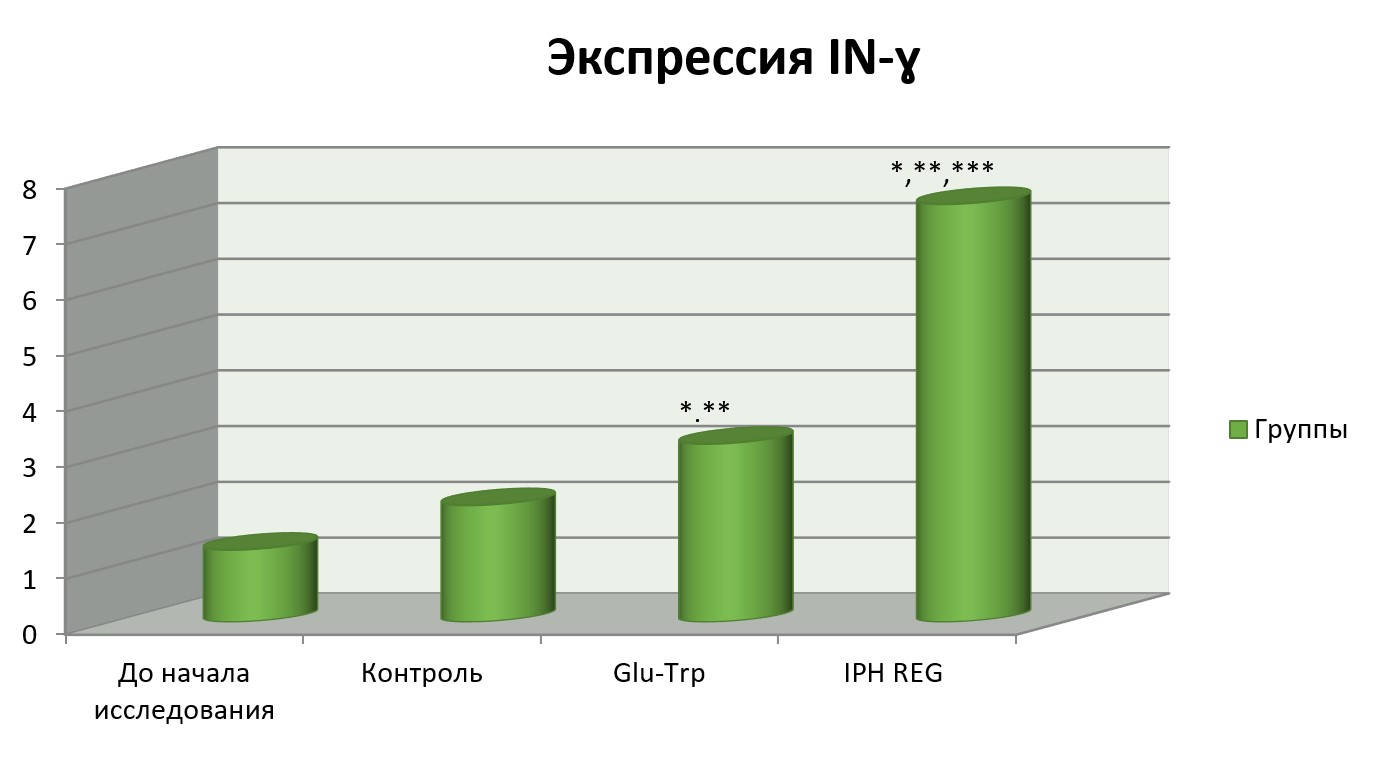
*p<0,05 по сравнению с исходными данными;
**p<0,05 по сравнению с контролем;
***p<0,05 между показателями уровня экспрессии при применении Glu-Trp и IPH REG.
Влияние пептида IPH REG на экспрессию CD90 в культурах клетки человека
На рисунке 4 показано, что применение пептида IPH REG увеличивает выработку CD90, который в минимальном количестве находится в изучаемых клетках, что позволяет судить о высокой противоопухолевой способности изучаемого пептида, так как CD90 является антиапоптотическим фактором по отношению к лимфоидным клеткам, особенно Т-лимфоцитам, и снижение его экспрессии в популяции нейронов или лимфоидных клеток влечет за собой развитие нейрогенных опухолей, лимфобластозов и других новообразований.
Рисунок 4. Влияние пептида IPH REG на экспрессию СD90 в культуре клеток человека.
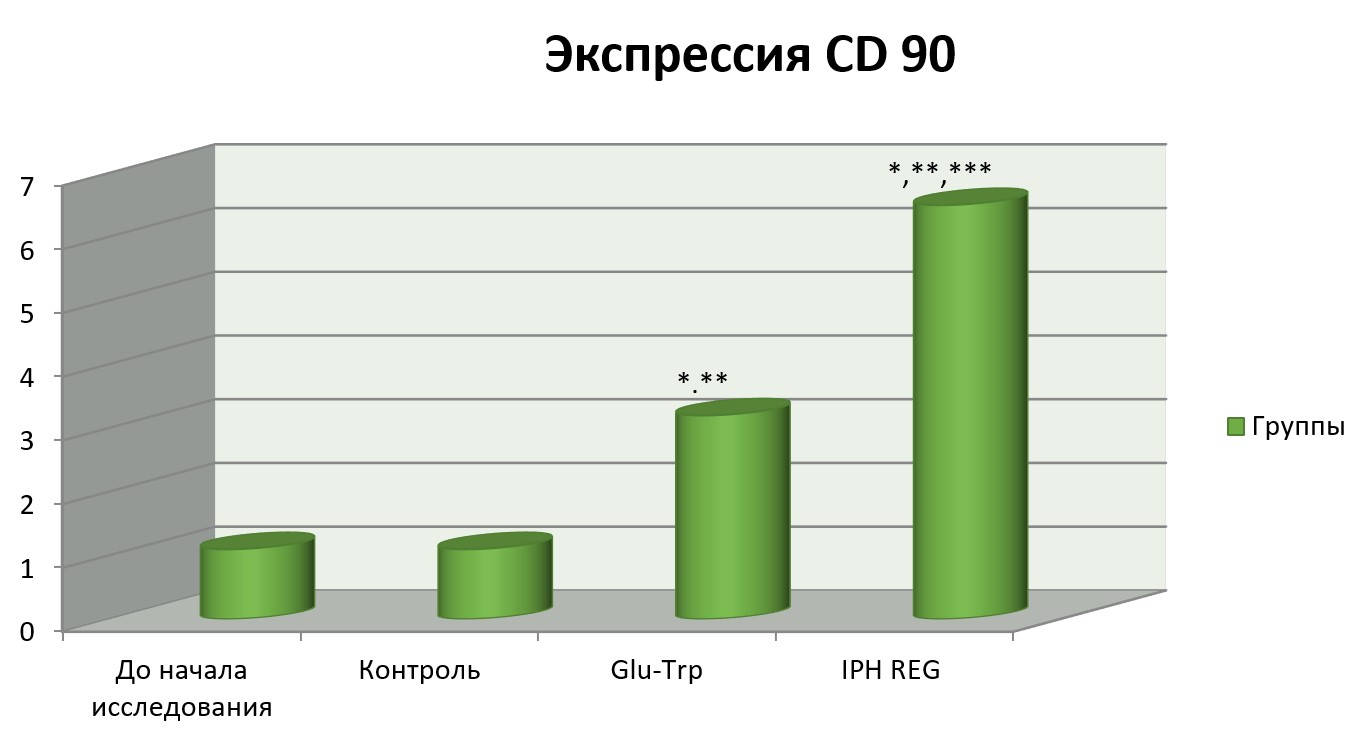
*p<0,05 по сравнению с исходными данными;
**p<0,05 по сравнению с контролем;
***p<0,05 между показателями уровня экспрессии при применении Glu-Trp и IPH REG.
Влияние пептида IPH REG на экспрессию INK-ATTAC в культурах клетки человека
На рисунке 5 и 6 показано, что применение пептида IPH REG увеличивает выработку INK-ATTAC, который способствует восстановлению функциональной активности клеток и реализует свои эффекты через активацию синтеза проапоптотического транскрипционного фактора р53, соответственно, оказывая регенерирующее действие и показывая высокую способность к репарации.
Рисунок 5. Влияние пептида IPH REG на экспрессию INK-ATTAC в культуре клеток человека.
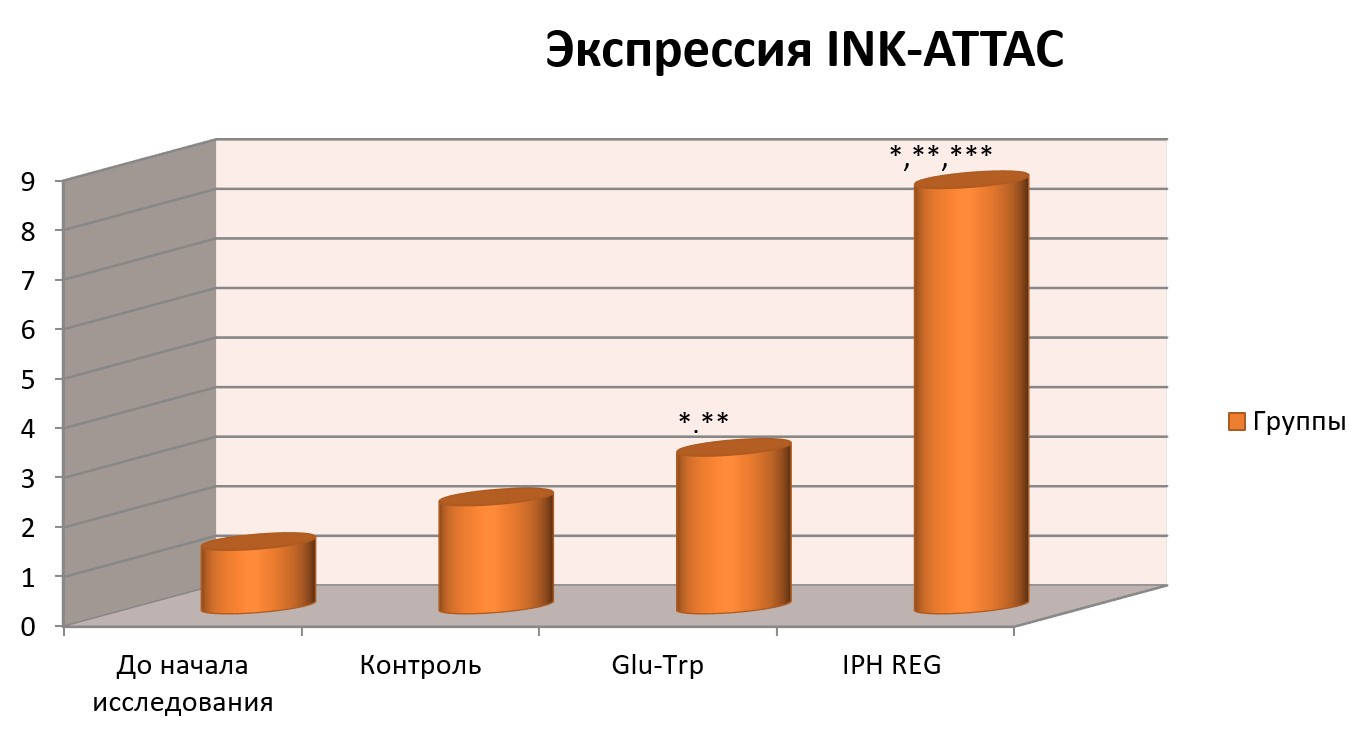
*p<0,05 по сравнению с исходными данными;
**p<0,05 по сравнению с контролем;
***p<0,05 между показателями уровня экспрессии при применении Glu-Trp и IPH REG.
Рисунок 6. Экспрессия INK-ATTAC в культуре клеток человека под влиянием пептида IPH REG. Конфокальная микроскопия. Х400.
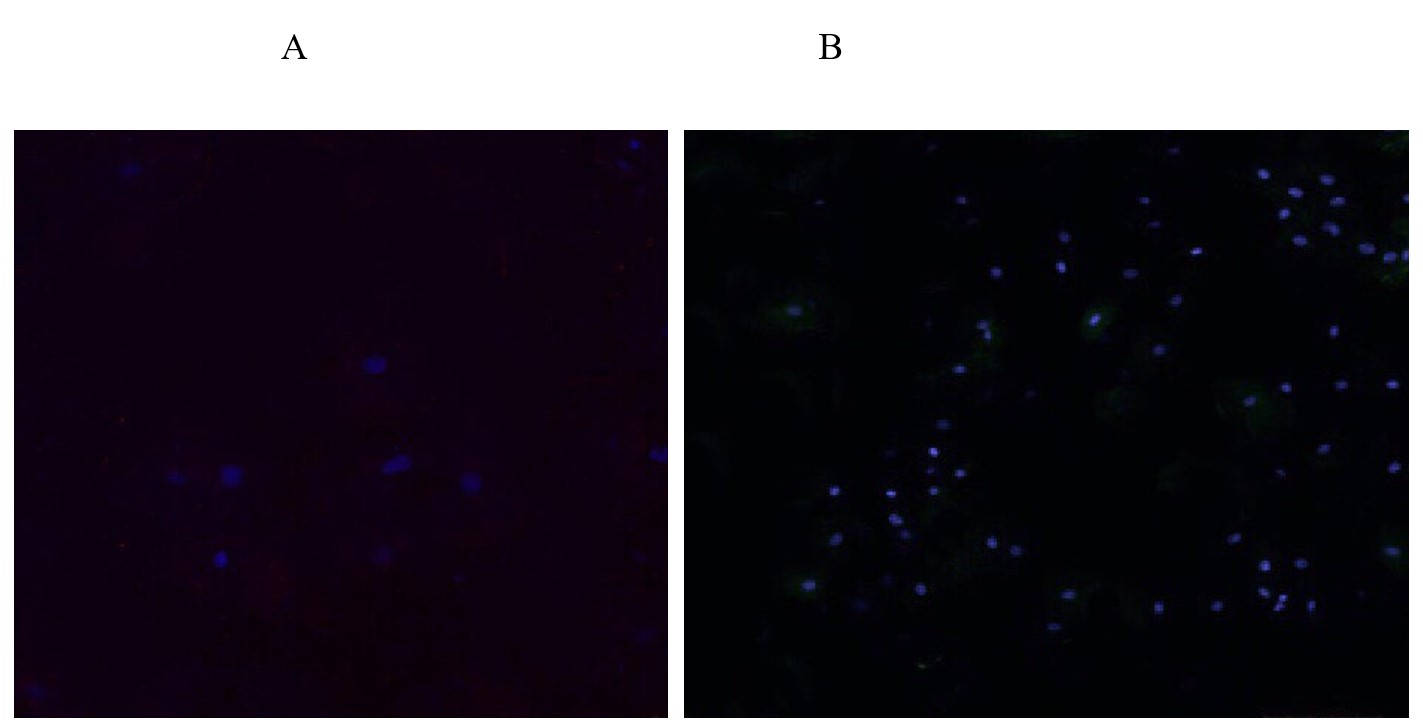
А- до начала исследования
В- после применения пептида IPH REG
Влияние пептида IPH REG на экспрессию белка р53 в культурах клетки человека
На рисунке 7 показано, что применение пептида IPH REG увеличивает выработку белка р53, который является транскрипционным фактором, выполняющим функцию супрессора образования злокачественных опухолей путем активации апоптоза в тканях организма, что позволяет сделать вывод о репаративных свойствах изучаемого пептида.
Рисунок 7. Влияние пептида IPH REG на экспрессию белка p53 в культуре клеток человека.
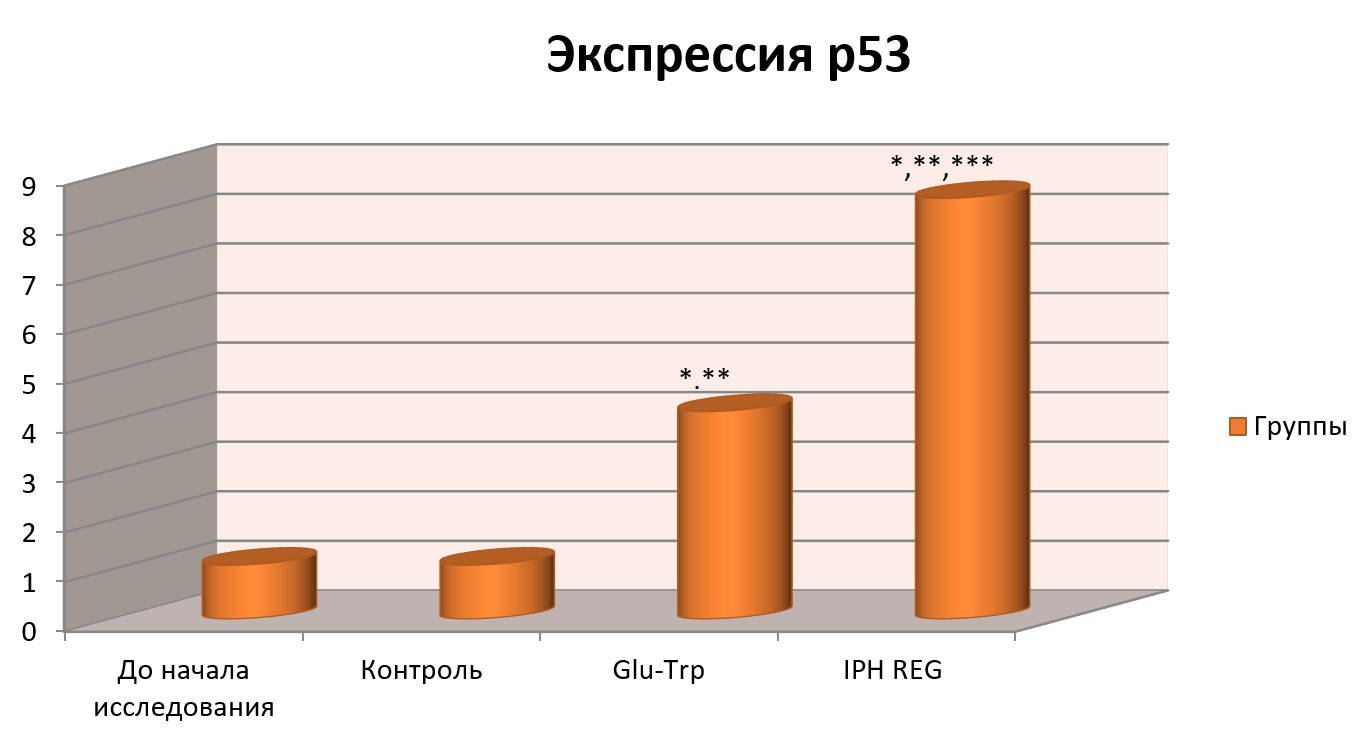
*p<0,05 по сравнению с исходными данными;
**p<0,05 по сравнению с контролем;
***p<0,05 между показателями уровня экспрессии при применении Glu-Trp и IPH REG.
Р53-зависимый апоптоз также позволяет избежать накопления мутаций, а, в случае, когда они уже возникли, p53-зависимый апоптоз позволяет элиминировать такие потенциально опасные для организма клетки, что позволяет сделать вывод о регенерирующем и репаративном действии изучаемого пептида.
ЗАКЛЮЧЕНИЕ
Выполненные исследования подтверждают регенерирующее и антиоксидантное свойства пептида IPH REG по данным экспрессии генов и биологически активных молекул на культуре клетки. Полученные данные подтверждают высокую способность пептида IPH REG к репарации поврежденных участков ДНК и регенерации клеток.




