ВВЕДЕНИЕ
В настоящее время большой интерес представляет изучение свойств пептидов. Пептиды имеют ту же структуру, что и белки (протеины), но размер этих молекул меньше. Важно также отметить, что короткие пептиды, являясь естественным продуктом обмена веществ, присутствующих в организме, не могут быть выявлены в крови или моче. В связи с этим интерес представляет изучение свойств отдельных структур на клеточных культурах.
Пептид IPH-VGA представляет собой пептидный комплекс, содержащий определённую последовательность аминокислот и обладающий нормализующим действием на клетки стенки и детрузора мочевого пузыря.
Результаты экспериментальных исследований показали, что пептид IPH-VGA обладает тканеспецифическим действием на клетки стенки и сфинктера мочевого пузыря, улучшает их трофику и оказывает регулирующее действие на обменные процессы в них, способствует нормализации функциональных и морфологических изменений в семенниках, снижая риск возникновения различных патологических процессов. Это позволяет предполагать цитопротективные и другие эффекты применения пептида IPH VGA в отношении мочевой системы.
Дизайн исследования
1 этап.
Для оценки цитостатических, иммуномодулирующих, геропротекторных и онкопротекторных свойств пептида IPHVGA в отношении мочевой системы нами были выбраны эмбриональные стволовые клетки (ЭСК), которые относятся к плюрипотентному типу, это значит, что они могут дифференцироваться во все три первичных зародышевых листка: эктодерму, энтодерму и мезодерму, из которых в дальнейшем образуются органы и железы мочевой и других систем. Эмбрион человека достигает стадии бластоцисты, из которой получают стволовые клетки, спустя 5-6 дней после оплодотворения.
При нормальной половой дифференцировке окончательное строение всех структур мочевой и репродуктивной систем соответствует набору половых хромосом в клетках (XX или XY). Для формирования яичников необходим набор хромосом 46,XX, а также такие генетические факторы, как DAX-1 и сигнальная молекула WNT-4. Формирование мужского фенотипа требует присутствия Y-хромосомы, в частности гена SRY (Sex-determiningRegionY), который в сочетании с генами SOX9, SF1, WT1 и некоторыми другими определяет развитие яичек из недифференцированных гонад.
Первый гормон яичек, фактор регрессии мюллеровых протоков (MIF-MullerianInhibitingFactor), начинает вырабатываться на 6-7-й неделе внутриутробного развития. Активация этого гена требует функционирования гена, кодирующий стероидогенный фактор SF1. SF1 принадлежит к большому семейству ядерных рецепторов, которые представляют собой ДНК-связывающие транскрипционные факторы. Он представляет собой белок, состоящий из 461 аминокислоты, который имеет ДНК-связывающий домен (DBD), лиганд-связывающий домен (LBD) и два активирующих домена — AF-1 (активатор функции 1) и AF-2 (активатор функции 2).
Таким образом, основные гены, участвующие в дифференцировке гонад и онтогенезе органов мочевой и репродуктивной систем:
— мужских: SRY, SOX9, WT1, гена, кодирующий стероидогенный фактор SF1,
— женских: ген DAX-1 и ген молекулы WNT-4.
Нами была оценена экспрессия генов, отвечающих за онтогенез мочевой и репродуктивной систем, в частности, влияние пептидаIPHVGAна экспрессию генов, ответственных за синтез половых белков –гормонов и рецепторов к этим гормонам и генов, участвующих непосредственно в онтогенезе.
2 этап.
Вторым этапом нашего экспериментального исследования была оценка маркерных биологических активных молекул иммунофлуоресцентным методом с использованием первичных антител к белку Ki67 (1:75, Abcam), p53 (1:50, Abcam).
Нами были выбраны следующие маркерные биологически активные молекулы:
1) Белок Ki67 является общепризнанным и широко используемым маркером пролиферации, экспрессирующимся во всех типах тканей. Процесс старения характеризуется достижением предела Хейфлика и снижением либо полным прекращением способности клеток к делению. В связи с этим белок Ki67 может являться важным маркером для оценки снижения пролиферативной активности клеток и степени инволютивных процессов в исследуемом органе.
2) Старение полипотентных клеток в культуре связано с увеличением активности гена p53. У мышей, имеющих мутацию в гене p53, отмечена повышенная устойчивость к развитию новообразований в сочетании с сокращением средней продолжительности жизни. Белок p53 играет ключевую роль в эндогенных противоопухолевых механизмах [Donekoveretal., 2002]. Белок p53 осуществляет контроль над течением процессов клеточного цикла, а также за отсутствием в геноме повреждений, которые могли бы привести к дальнейшему развитию патологии. Белок р53 является транскрипционным фактором, выполняющим функцию супрессора образования злокачественных опухолей путем активации апоптоза в тканях организма. Белок р53 активируется при повреждениях ДНК, а также при стимулах, которые могут привести к подобным повреждениям или являются сигналом о старении клетки и нарушении ее функциональной активности [ArshadH. etal., 2010].Р53-зависимый апоптоз позволяет избежать накопления мутаций, а, в случае, когда они уже возникли, p53-зависимый апоптоз позволяет элиминировать такие потенциально опасные для организма клетки [BurtisC., AshwoodE., BrunsD., 2006].
Материалы исследования.
Для изучения свойств пептида IPHVGA нами были использованы следующие клеточные культуры Российской коллекции клеточных культур позвоночных (РККК П):
SC5
Происхождение: человек, эмбриональные стволовые клетки (ЭСК), бластоциста (5-6 день развития), полученные в результате ЭКО
Science. 1998. 282: 1145 – 1147; Онтогенез. 2011. 42 (4): 249 – 263;
Цитология. 2012. 54 (1): 5 – 16.
Морфология: колонии округлых клеток с высоким ядерно/цитопламатическим отношением.
Способ культивирования: монослойный; колонии прикреплены к митотически инактивированному (митомицин-С) фидерному слою мезенхимных клеток костного мозга эмбриона человека.
Условия культивирования: среда — KnockoutDulbecco’smodifiedEaglesmediumсыворотка — KnockoutSerumReplacement 20%др. компоненты – NEAA 1%, L-глютамин 2mM, 2- меркаптоэтанол 0.1 mM, bFGF — 8 нг/мл
процедура пересева – механический пересев культуры ЭСК проводили под контролем микроскопа путем разделения колонии на фрагменты с помощью одноразового скальпеля и переноса их на новый слой фидера; ежедневная смена среды, пересев каждые 5-6 дней.
криоконсервация — ростовая среда, 10% DMSO, 5х105 клеток/мл в ампуле.
Жизнеспособность после криоконсервации: 60 % (окраска трипановым синим на нулевом пассаже)
Контроль контаминации: бактерии, грибы и микоплазма не обнаружены.
Контроль видовой идентичности: кариологический анализ.
Кариология: 2n= 46, модальное число хромосом 46 (98.0+0.9 %), нормальный кариотип человека (46, XХ), количество полиплоидов (0.2 + 0.2%).
ДНК профиль (STR): Amelogenin: X, X
CSF1PO: 12, 13
D13S317: 8, 11
D16S539: 9, 12
D5S818: 9, 11
D7S820: 8,10,12
THO1: 6, 9.3
TPOX: 10, 11
vWA: 17,17
Другие характеристики:
Среднее время одного удвоения клеточной популяции 28.2 ч.
Линия иммортализованная, прошла более 120 удвоение клеточной популяции.
Экспрессия поверхностных антигенов, характерных для ЭСК человека: SSEA-4, TRA-1-60 и транскрипционных факторов Осt-4, Nanog.
Способность к спонтанной дифференцировке в производные 3-х зародышевых листков.
Способность к образованию invivo тератом, содержащих производные 3-х зародышевых листков.
Область применения: клеточная биология, эмбриология.
Коллекции: Институт цитологии Российской академии наук (Рисунок 1)(Федеральное государственное бюджетное учреждение науки «Институт цитологии Российской академии наук, М.С. Богданова, Г.Г. Полянская, А.М. Кольцова «Клеточные культуры» Информационный бюллетень. Вып. 34 (2018).
Рисунок 1. Культура эмбриональные стволовые клетки SC 5. Световая микроскопия, х400.

Методы исследования
Группы для исследования:
1 группа – измерение экспрессии молекул до начала исследования,
2 группа — контроль (добавление питательной среды, инкубирование сывороточным альбумином),
3 группа – добавление контрольного пептида дипептида Glu-Trp в концентрации 100 микрограммов(мкг);
4 группа – добавление пептида IPH-VGA в концентрации 100 микрограммов(мкг).
Для исследования использовали пептиды IPH-VGA и Glu-Trp в форме лиофилизированного порошка,которые растворяли стерильной водой для инъекций в объёме 10 мл до конечной концентрации пептидов 100 мкг.
Для большинства диссоциированных клеточных культур, как было показано ранее, наиболее эффективной является концентрация пептидов 100 мкг/мл по многолетнему опыту применения пептидов [Линькова Н.С. и др., 2016; KhavinsonV. etal., 2017].
В качестве контроля выбран иммунопротекторный пептид Glu-Trp с известными и хорошо описанными в литературе свойствами [Морозов В.Г., Хавинсон В.Х., Малинин В.В., 2000, Хавинсон В.Х., Морозов В.Г., 2001, Хавинсон В.Х., Кузник Б.И., Линькова Н.С., Проняева В.Е., 2013].
Для измерения уровня экспрессии генов применяли PCR-метод с использованием собственных праймеров и реагентов фирмы Novocastaи наборы моноклональныхантител производства фирмы Biosource (Бельгия).
Мазки клеток обрабатывались соответствующими первичными антителами по стандартному протоколу:
- Трехкратная промывка фосфатно-солевым буфером — ФСБ(рН=7,2) по 5 мин;
- Пермеабилизация клеток 0,1% TritonX-100, растворенном в ФСБ, в течение 15 мин;
- Промывка в трех сменах ФСБ (по 5 мин);
- Инкубация в 1% бычьем сывороточном альбумине (разведенным ФСБ, pH 7,5) в течение 30 мин для блокировки неспецифического связывания;
- Инкубация с первичными антителами, 60 мин;
- Промывка в трех сменах ФБС (по 5 мин);
- Инкубация со вторичными антителами, конъюгированными с флуорохромомAlexaFluor488 (1:1000, Abcam) 30 мин при комнатной температуре в темноте;
- Промывка в трех сменах ФСБ по 5 мин;
- Докраска ядер клеток красителем Hoechst 33258 (Sigma, США) (1:100 от стокового раствора в dH2O) в течение 1 мин (краситель используется в качестве флуоресцентного маркера ДНК, при связывании с которой его флуоресценция усиливается).
- Промывка в ФСБ 5 мин;
- Заключение готовых препаратов под покровные стекла в монтирующую среду DakoFluorescentMountingMedium (Dako).
Изучение препаратов проводили в конфокальном микроскопе OlympusFluoView FV1000 при увеличении 200, 400, 600. Синим цветом флуоресцирует экспрессия исследуемого маркера. Проводили измерение относительной площади экспрессии в %. Относительную площадь экспрессии рассчитывали, как отношение площади, занимаемой иммунопозитивными клетками, к общей площади клеток в поле зрения и выражали в процентах. Динамика экспрессии генов измерена в условных единицах, базовый уровень принят за 10.
Статистическая обработка результатов
Статистическая обработка экспериментальных данных включала в себя подсчет среднего арифметического, стандартного отклонения и доверительного интервала для каждой выборки и проводилась в программе Statistica11.0. Если данные подчинялись нормальному распределению, различия в средних определялись с помощью критерия Стюдента (t).
Результаты исследования
Влияние пептида IPH-VGA на экспрессию генов, ответственных за мочевую и репродуктивную системы человека
Так, на рисунке 2 нами показано, что пептид IPHVGA достоверно увеличивает экспрессию генов, отвечающих за нормальное образование как органов мочевой системы, так и факторов, формирующих онтогенез.
Рисунок 2. Суммарная экспрессия генов, участвующих в дифференцировке гонад и онтогенезе органов мочевой системы: SRY, SOX9, WT1, гена, кодирующий стероидогенный фактор SF1.
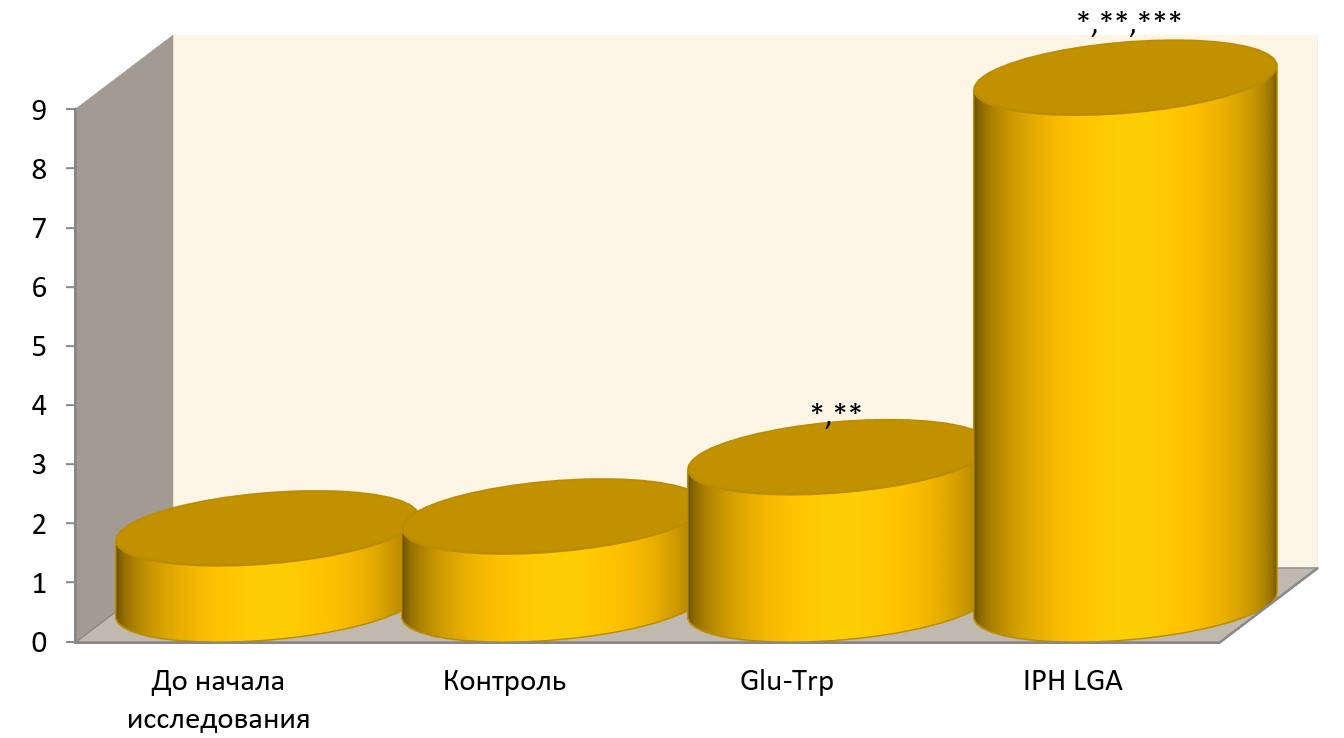
*p<0,05 по сравнению с исходными данными;
**p<0,05 по сравнению с контролем;
***p<0,05 между показателями уровня экспрессии при примененииGlu-Trp и IPH-VGA.
Таким образом, из приведенных данных видно, что под воздействием пептида IPH-VGA в культуре клеток человека происходит статистически достоверное увеличение экспрессии генов, ответственных за онтогенез мочевой системы и гормонального фона. Эти данные показывают, что пептид IPH-VGA достоверно увеличивает в культуре клеток человека «каскад» сигнальных молекул, который необходим для активации процессов пролиферации и дифференцировки стволовых клеток в клетки мочевой системы.
Влияние пептида IPH-VGA на экспрессию белка р53 в культурах клетки человека
На рисунке 3 показано, что применение пептидаIPHVGAувеличивает выработку белка р53, который является транскрипционным фактором, выполняющим функцию супрессора образования злокачественных опухолей путем активации апоптоза в тканях организма, что позволяет сделать вывод о противоопухолевых свойствах изучаемого пептида.
Рисунок 3. Влияние пептида IPH-VGA на экспрессию белка p53 в культуре клеток человека.
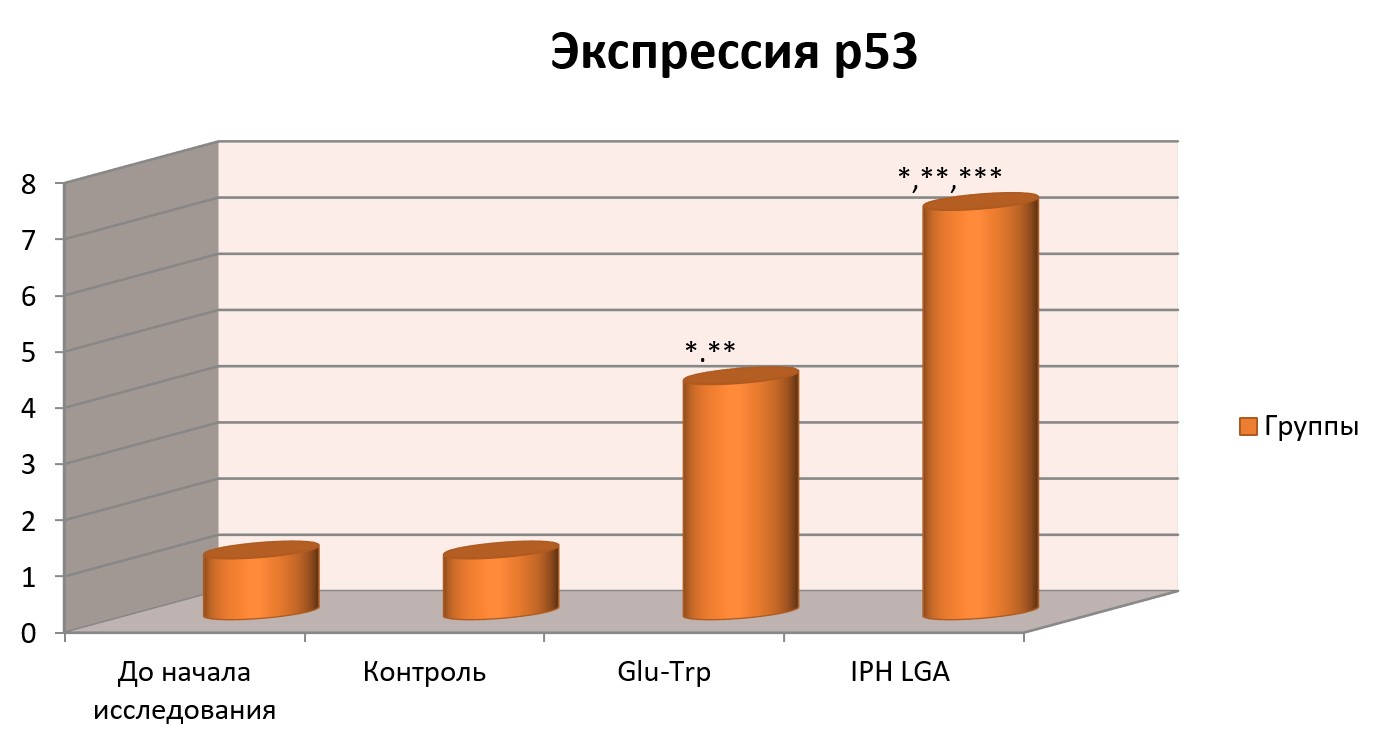
*p<0,05 по сравнению с исходными данными;
**p<0,05 по сравнению с контролем;
***p<0,05 между показателями уровня экспрессии при применении Glu-Trp и IPH-VGA.
Р53-зависимый апоптоз также позволяет избежать накопления мутаций, а, в случае, когда они уже возникли, p53-зависимый апоптоз позволяет элиминировать такие потенциально опасные для организма клетки, что позволяет сделать вывод о цитопротекторном действии изучаемого пептида.
Влияние пептида IPHVGAна экспрессию белка Ki67в культурах клетки человека.
На рисунке 4 показано, что применение пептида IPH-VGA уменьшает выработку белка Ki67, который является маркером пролиферацииопухолевых клеток, это означает, что пептид IPH-VGA обладает противоопухолевой активностью.
Рисунок 4. Влияние пептида IPH-VGA на экспрессию белкаKi67 в культуре клеток человека.
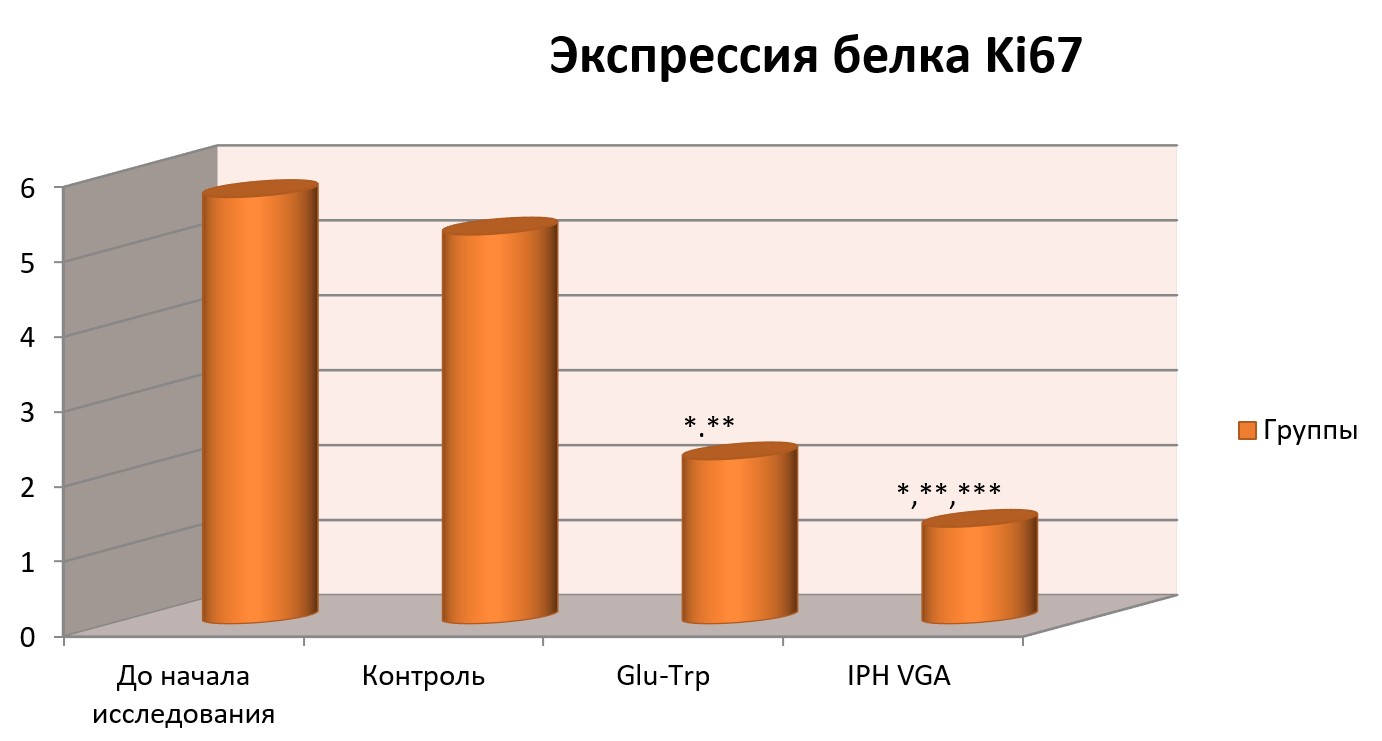
*p<0,05 по сравнению с исходными данными;
**p<0,05 по сравнению с контролем;
***p<0,05 между показателями уровня экспрессии при применении Glu-Trp и IPH-VGA.
Белок Ki67 может являться важным маркером для оценки снижения пролиферативной активности клеток и степени инволютивных процессов в исследуемом органе.
ЗАКЛЮЧЕНИЕ
Выполненные исследования подтверждают высокую биологическую активность пептида IPH-VGA в отношении контроля нормального формирования мочевой системы у человека на генетическом уровне, восстановления работы мочевой системы, а также подтверждают информацию о цитостатических и онкопротекторных свойствах пептида IPHVGA в отношении мочевой системы человека по данным экспрессии биологических молекул на культуре клетки.




