В настоящее время большой интерес представляет изучение свойств пептидов [Dudgeon W.D. et al., 2016]. Пептиды имеют ту же структуру, что и белки (протеины), но размер этих молекул меньше. Важно также отметить, что короткие пептиды, являясь естественным продуктом обмена веществ, присутствующих в организме, не могут быть выявлены в крови или моче. В связи с этим интерес представляет изучение свойств отдельных структур на клеточных культурах.
Пептид IPH- AVN содержит низкомолекулярный пептид, обладает ангио – и вазопротекторными свойствами и оказывает нормализующее действие на сосудистую систему.
Экспериментальные исследования показали, что пептид IPH- AVN регулирует процессы метаболизма в сосудах, снижает проницаемость сосудистой стенки, повышает резервные возможности организма, что позволяет предполагать эффективность применения пептида IPH- AVN для нормализации функций сосудистой системы человека при нарушениях различного генеза.
В связи с этим целью нашего исследования было изучение ангиопротекторных и других свойств пептида.
Дизайн исследования
1 этап.
Для оценки цитостатических и агиопротекторных свойств пептида IPH-AVN в отношении сосудистой системы нами были выбраны эмбриональные стволовые клетки (ЭСК), которые относятся к плюрипотентному типу, это значит, что они могут дифференцироваться во все три первичных зародышевых листка: эктодерму, энтодерму и мезодерму, из которых в дальнейшем образуются ткани сосудистой системы. Эмбрион человека достигает стадии бластоцисты, из которой получают стволовые клетки, спустя 5-6 дней после оплодотворения.
Гены, ответственные за формирование сосудистой системы, составляют комплекс из генов ACE, AGT, AGTR2, NOS3, MTHFR. Ген ACE (ангиотензин-1 превращающий фермент — АПФ) картирован в локусе 17q23. Гены AGT и AGTR1, которые кодируют ангиотензиноген и рецептор типа 1 к ангиотензину II, а продукт гена NOS3 — NO-синтаза — является ключевым ферментом регуляции тонуса кровеносных сосудов, работы гладкомышечной мускулатуры сосудистой стенки и процессов тромбообразования. Ген метилентетрагидрофолатредуктазы (MTHFR) регулирует обмен гомоцистеина в клетке. Полиморфизм генов NOS3 и MTHFR ассоциирован с предрасположенностью к сердечно-сосудистым заболеваниям.
В связи с этими данными нами было принято решение изучить активность данного комплекса генов при применении пептида IPH- AVN.
Нами была произведена оценка экспрессия генов, отвечающих за онтогенез сосудистой системы.
2 этап.
Вторым этапом нашего экспериментального исследования была оценка маркерных биологических активных молекул иммунофлуоресцентным методом с использованием первичных антител к белку VEGF (1:250, Abcam) и белку p53 (1:50, Abcam).
Нами были выбраны следующие маркерные биологически активные молекулы:
1) VEGF (фактор роста эндотелия сосудов) — сигнальный белок, вырабатываемый клетками для стимуляции васкулогенеза (образование эмбриональной сосудистой системы) и ангиогенеза (рост новых сосудов в уже существующей сосудистой системе) [Anteby E.Y. et al., 2004].
2) Старение полипотентных клеток в культуре связано с увеличением активности гена p53. У мышей, имеющих мутацию в гене p53, отмечена повышенная устойчивость к развитию новообразований в сочетании с сокращением средней продолжительности жизни. Белок p53 играет ключевую роль в эндогенных противоопухолевых механизмах [Donekover et al., 2002]. Белок p53 осуществляет контроль над течением процессов клеточного цикла, а также за отсутствием в геноме повреждений, которые могли бы привести к дальнейшему развитию патологии. Белок р53 является транскрипционным фактором, выполняющим функцию супрессора образования злокачественных опухолей путем активации апоптоза в тканях организма. Белок р53 активируется при повреждениях ДНК, а также при стимулах, которые могут привести к подобным повреждениям или являются сигналом о старении клетки и нарушении ее функциональной активности [Arshad H. et al., 2010]. Р53-зависимый апоптоз позволяет избежать накопления мутаций, а, в случае, когда они уже возникли, p53-зависимый апоптоз позволяет элиминировать такие потенциально опасные для организма клетки [Burtis C., Ashwood E., Bruns D., 2006].
Материалы исследования.
Для изучения свойств пептида IPH-AVN нами были использованы следующие клеточные культуры Российской коллекции клеточных культур позвоночных (РККК П):
SC5
Происхождение: человек, эмбриональные стволовые клетки (ЭСК), бластоциста (5-6 день развития), полученные в результате ЭКО
Science. 1998. 282: 1145 – 1147; Онтогенез. 2011. 42 (4): 249 – 263;
Цитология. 2012. 54 (1): 5 – 16.
Морфология: колонии округлых клеток с высоким ядерно/цитопламатическим отношением.
Способ культивирования: монослойный; колонии прикреплены к митотически инактивированному (митомицин-С) фидерному слою мезенхимных клеток костного мозга эмбриона человека.
Условия культивирования: среда — Knockout Dulbecco’s modified Eagles medium сыворотка — Knockout Serum Replacement 20% др. компоненты – NEAA 1%, L-глютамин 2mM, 2- меркаптоэтанол 0.1 mM, bFGF — 8 нг/мл
процедура пересева – механический пересев культуры ЭСК проводили под контролем микроскопа путем разделения колонии на фрагменты с помощью одноразового скальпеля и переноса их на новый слой фидера; ежедневная смена среды, пересев каждые 5-6 дней.
криоконсервация — ростовая среда, 10% DMSO, 5х105 клеток/мл в ампуле.
Жизнеспособность после криоконсервации: 60 % (окраска трипановым синим на нулевом пассаже)
Контроль контаминации: бактерии, грибы и микоплазма не обнаружены.
Контроль видовой идентичности: кариологический анализ.
Кариология: 2n= 46, модальное число хромосом 46 (98.0+0.9 %), нормальный кариотип человека (46, XХ), количество полиплоидов (0.2 + 0.2%).
ДНК профиль (STR): Amelogenin: X, X
CSF1PO: 12, 13
D13S317: 8, 11
D16S539: 9, 12
D5S818: 9, 11
D7S820: 8,10,12
THO1: 6, 9.3
TPOX: 10, 11
vWA: 17,17
Другие характеристики:
Среднее время одного удвоения клеточной популяции 28.2 ч.
Линия иммортализованная, прошла более 120 удвоение клеточной популяции.
Экспрессия поверхностных антигенов, характерных для ЭСК человека: SSEA-4, TRA-1-60 и транскрипционных факторов Осt-4, Nanog.
Способность к спонтанной дифференцировке в производные 3-х зародышевых листков.
Способность к образованию in vivo тератом, содержащих производные 3-х зародышевых листков.
Область применения: клеточная биология, эмбриология.
Коллекции: Институт цитологии Российской академии наук (Рисунок 1) (Федеральное государственное бюджетное учреждение науки «Институт цитологии Российской академии наук, http://www.cytspb.rssi.ru/eotk/infbull_ru.htm, М.С. Богданова, Г.Г. Полянская, А.М. Кольцова «Клеточные культуры» Информационный бюллетень. Вып. 34 (2018),
http://www.cytspb.rssi.ru/rkkk/katalog1n_2017_with_figs.pdf).
Методы исследования
Группы для исследования:
1 группа – измерение экспрессии молекул до начала исследования,
2 группа — контроль (добавление питательной среды, инкубирование сывороточным альбумином),
3 группа – добавление контрольного пептида дипептида Glu-Trp в концентрации 100 микрограммов (мкг);
4 группа – добавление пептида IPH-AVN в концентрации 100 микрограммов (мкг).
Для исследования использовали пептиды IPH-AVN и Glu-Trp в форме лиофилизированного порошка, которые растворяли стерильной водой для инъекций в объёме 10 мл до конечной концентрации пептидов 100 мкг.
Для большинства диссоциированных клеточных культур, как было показано ранее, наиболее эффективной является концентрация пептидов 100 мкг/мл по многолетнему опыту применения пептидов [Линькова Н.С. и др., 2016; Khavinson V. et al., 2017].
В качестве контроля выбран иммунопротекторный пептид Glu-Trp с известными и хорошо описанными в литературе свойствами [Морозов В.Г., Хавинсон В.Х., Малинин В.В., 2000, Хавинсон В.Х., Морозов В.Г., 2001, Хавинсон В.Х., Кузник Б.И., Линькова Н.С., Проняева В.Е., 2013].
Для измерения уровня экспрессии генов применяли PCR-метод с использованием собственных праймеров и реагентов фирмы Novocasta и наборы моноклональных антител производства
фирмы Biosource (Бельгия).
Мазки клеток обрабатывались соответствующими первичными антителами по стандартному протоколу:
- Трехкратная промывка фосфатно-солевым буфером — ФСБ(рН=7,2) по 5 мин;
- Пермеабилизация клеток 0,1% Triton X-100, растворенном в ФСБ, в течение 15 мин;
- Промывка в трех сменах ФСБ (по 5 мин);
- Инкубация в 1% бычьем сывороточном альбумине (разведенным ФСБ, pH 7,5) в течение 30 мин для блокировки неспецифического связывания;
- Инкубация с первичными антителами, 60 мин;
- Промывка в трех сменах ФБС (по 5 мин);
- Инкубация со вторичными антителами, конъюгированными с флуорохромом Alexa Fluor 488 (1:1000, Abcam) 30 мин при комнатной температуре в темноте;
- Промывка в трех сменах ФСБ по 5мин;
- Докраска ядер клеток красителем Hoechst 33258 (Sigma, США) (1:100 от стокового раствора в dH2O) в течение 1 мин (краситель используется в качестве флуоресцентного маркера ДНК, при связывании с которой его флуоресценция усиливается).
- Промывка в ФСБ 5 мин;
- Заключение готовых препаратов под покровные стекла в монтирующую среду Dako Fluorescent Mounting Medium (Dako).
Изучение препаратов проводили в конфокальном микроскопе Olympus FluoView FV1000 при увеличении 200, 400, 600. Синим цветом флуоресцирует экспрессия исследуемого маркера. Проводили измерение относительной площади экспрессии в %. Относительную площадь экспрессии рассчитывали, как отношение площади, занимаемой иммунопозитивными клетками, к общей площади клеток в поле зрения и выражали в процентах. Динамика экспрессии генов измерена в условных единицах, базовый уровень принят за 10.
Статистическая обработка результатов
Статистическая обработка экспериментальных данных включала
в себя подсчет среднего арифметического, стандартного отклонения
и доверительного интервала для каждой выборки и проводилась
в программе Statistica 11.0. Если данные подчинялись нормальному распределению, различия в средних определялись с помощью критерия Стъюдента (t).
Результаты исследования и их обсуждение
Влияние пептида IPH—AVN на экспрессию генов, ответственных за формирование сосудистой системы
Так, на рисунке 2 нами показано, что пептид IPH-AVN достоверно увеличивает экспрессию комплекса из генов ACE, AGT, AGTR2, NOS3, MTHFR, отвечающих за нормальное образование и формирование сосудистой системы, в частности, регулирующих тонус кровеносных сосудов, работу гладкомышечной мускулатуры сосудистой стенки и процессов тромбообразования.
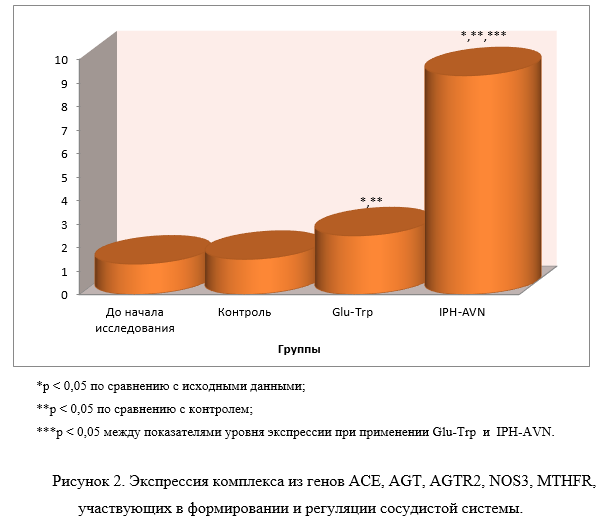
Таким образом, из приведенных данных видно, что под воздействием пептида IPH-AVN в культуре клеток человека происходит статистически достоверное увеличение экспрессии генов, ответственных за онтогенез сосудистой системы. Эти данные показывают, что пептид IPH-AVN достоверно увеличивает в культуре клеток человека «каскад» сигнальных молекул, который необходим для активации процессов пролиферации и дифференцировки стволовых клеток в клетки сосудистой системы, формирования системы сосудов, регуляции метаболизма в эпителиоцитах, регуляции тонуса кровеносных сосудов, работы гладкомышечной мускулатуры сосудистой стенки и процессов тромбообразования.
Влияние пептида IPH—AVN на экспрессию белка VEGF в культурах клетки человека
На рисунке 3 показано, что применение пептида IPH-AVN повышает экспрессию белка VEGF в 4,5 раза от исходного уровня, который является фактором роста эндотелия сосудов.
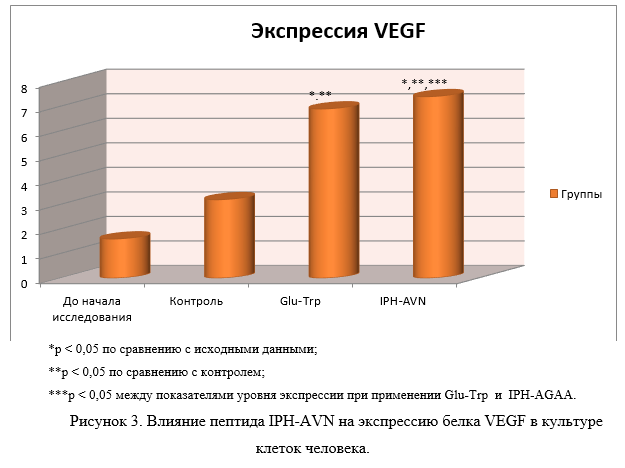
Таким образом, применение пептида IPH-AVN носит выраженный ангиопротекторный характер, в частности, индуцирует дифференцировку полипотентных миогенных клеток в направлении нормального формирования сосудистой системы и стимулирует васкулогенез (образование эмбриональной сосудистой системы) и ангиогенез (рост новых сосудов в уже существующей сосудистой системе).
Влияние пептида IPH—AVN на экспрессию белка р53 в культурах клетки человека
На рисунке 4 показано, что применение пептида IPH-AVN увеличивает выработку белка р53, который является транскрипционным фактором, выполняющим функцию супрессора образования злокачественных опухолей путем активации апоптоза в тканях организма, что позволяет сделать вывод о противоопухолевых свойствах изучаемого пептида.
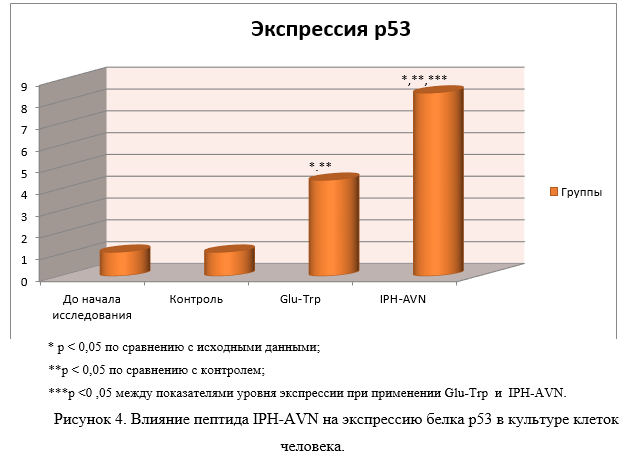
Р53-зависимый апоптоз также позволяет избежать накопления мутаций, а, в случае, когда они уже возникли, p53-зависимый апоптоз позволяет элиминировать такие потенциально опасные для организма клетки, что позволяет сделать вывод о цитопротекторном действии изучаемого пептида.
Полученные данные свидетельствуют о высокой онкопротекторной активности пептида IPH-AVN в отношении клеток сосудистой системы по данным экспрессии биологических молекул на культуре клетки.
ЗАКЛЮЧЕНИЕ
Выполненные исследования подтверждают высокую биологическую активность пептида IPH- AVN в отношении контроля нормального формирования сосудистой системы у человека на генетическом уровне по данным экспрессии генов, ответственных за онтогенез сосудистой системы, за нормальное образование и формирование сосудистой системы, в частности, регулирующих тонус кровеносных сосудов, работу гладкомышечной мускулатуры сосудистой стенки и процессов тромбообразования.
Пептид IPH-AVN достоверно увеличивает в культуре клеток человека «каскад» сигнальных молекул, который необходим для активации процессов пролиферации и дифференцировки стволовых клеток в клетки сосудистой системы, формирования системы сосудов, регуляции метаболизма в эпителиоцитах, регуляции тонуса кровеносных сосудов, работы гладкомышечной мускулатуры сосудистой стенки и процессов тромбообразования.
Применение пептида IPH-AVN носит выраженный ангиопротекторный характер, в частности, индуцирует дифференцировку полипотентных миогенных клеток в направлении нормального формирования сосудистой системы и стимулирует васкулогенез (образование эмбриональной сосудистой системы) и ангиогенез (рост новых сосудов в уже существующей сосудистой системе).
Полученные данные свидетельствуют о высокой онкопротекторной активности пептида IPH-AVN в отношении клеток сосудистой системы по данным экспрессии биологических молекул на культуре клетки.
Литература
- Баранов В.С.. Генетический паспорт — основа индивидуальной и предиктивной медицины / Под ред. В. С. Баранова. — СПб.: Изд-во Н-Л,2009. — 528 с.: ил.. 2009
- Линькова Н.С., Дробинцева А.О., Орлова О.А., Кузнецова Е.П., Полякова В.О., Кветной И.М., Хвинсон В.Х. Пептидная регуляция функций фибробластов кожи при их старении in vitro // Клеточные технологии в биологии и медицине. – 2016. — №1. – С. 40-44.
- Мутовин Г.Р.Основы клинической генетики (геномика и протеомика наследственной патологии). Учебное пособие для вузов в 2-х томах. Вып. 3. М.: ГЭОТАР-медиа, 2008.
- Хавинсон В.Х. Пептидная регуляция старения. СПб.: Наука, 2009. — 50 с.
- Arshad H., Ahmad Z., Hasan S.H. Gliomas: correlation of histologic grade, Ki67 and p53 expression with patient survival // Asian Pac J Cancer Prev. – 2010. – Vol. 11. – N 6. – P. 1637-1640;
- Orekhov A.N., Andreeva E.R., Bobryshev Y.V. Cellular mechanisms of human atherosclerosis: Role of cell-to-cell communications in subendothelial cell functions // Tissue Cell. — 2016. — V. 48. — N 1. — P. 25-34.




