«Пептидный бум» наших дней, который наблюдается на фармацевтическом рынке и в планах поисковых работ научных лабораторий, в значительной мере обусловлен фундаментальными научными достижениями последних лет в понимании физиологии, фармакологии и безопасности применения веществ пептидной природы, технологическими достижениями в создании чистых синтетических аналогов природных пептидов. К настоящему моменту получено около 2000 олиго — и полипептидов, в том числе реальных и потенциальных препаратов, причём число их расширяется. Важным открытием последних лет стали данные о том, что дипептиды, трипептиды , некоторые олигопептиды могут всасываться из кишечника без расщепления до отдельных аминокислот и попадать в различные органы и ткани, в частности в мозг, производя отчётливый терапевтический эффект. К настоящему моменту, на основе дипептидов, молекулы которых содержат два аминокислотных остатка, получены эффективные препараты различного фармакологического профиля действия : психоактивные, актопротективные, препараты иммуннотропного действия, средства метаболитной терапии, которые прошли клинические испытания и нашли широкое практическое применение. Как показывают доклинические и клинические исследования, терапевтические дозы препаратов пептидной природы, как правило на 2-3 порядка ниже терапевтических доз профильных не пептидных аналогов. Учитывая практическое отсутствие аллергических реакций на парентеральное и энтеральное введение коротких пептидов, сравнительно небольшие суммарные количества пептидных препаратов рекомендуемые для курсового применения, а также технические возможности создания точных копий природных олигопептидов, последние могут рассматриваться в качестве перспективного класса биологически активных веществ с большим спектром фармакологического потенциала.
Потребности фармакологической коррекции деятельности человека в экстремальных условиях напряженной работы, спорте высших достижений стали реальной основой поиска и создания новых средств развития и поддержания адаптационного потенциала организма, средств оптимизации использования резервных возможностей организма. Настоящая статья посвящена особенностям свойств и механизмов действия дипептида IPH AG , относительно нового средства пептидной природы, которое по нашему мнению, на основании доказательно установленного спектра активности, может быть отнесено к числу средств способных повышать устойчивость и сопротивляемость организма к широкому спектру экстремальных воздействий. Пептидный биорегулятор представляет собой кристалическое соединение белого цвета, состоящее из двух аминокислотных остатков: альфа-L-аминокислоты аланина и альфа-L-аминокислоты глутамина, ковалентно связанных пептидной связью, аналогичной существующим в белках (Рис.1). Обе аминокислоты являются природными эссенциальными физиологическими веществами, служат предшественниками синтеза белков, включаются в состав 20 стандартных аминокислот, играющих важную роль в синтезе множества естественных белков организма, обе важны для глобального обмена азота в организме, глюконеогенеза, энергетического обеспечения, пластического обмена и многих других физиологических процессов.
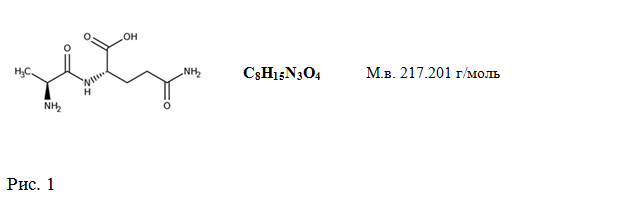
Структурная и брутто формула дипептида. Растворимость в воде 0.568 — 1 мг/мл
Дипептид реализует свое действие при разных путях введения в организм и, в зависимости от пути поступления, осуществляется преимущественно действие диссоцинированных молекул аланина и глутамина. При пероральном или энтеральном введении дипептид действует локально в желудочно-кишечном тракте, способствуя защите целостности слизистой оболочки кишечника, и поддержанию барьерных функций кишечника. В результате уменьшается возможность бактериальной транслокации, риск инфицирования, вызванное инфекцией воспалительное повреждение и связанные с инфекцией симптомы, такие как диарея, обезвоживание, мальабсорбция и дисбаланс электролитов. Установлен факт способности собственно дипептида при разных путях введения поддерживать интегративную функцию кишечника, ускоряя всасывание воды и электролитов из кишечника, ряда макро- и микронутриентов, оказывая, тем самым, регидратирующее действие и повышая последующее усвоение белков и жиров. Анализ хронологии развития действия при введении внутрь, позволил ввести условное разделение эффектов дипептида на срочные — развивающиеся в течение часа и связанные, в основном, с регидратацией и улучшением функций возбудимых тканей, и отсроченные, развивающиеся через часы и дни после поступления в организм, и проявляющиеся устойчивыми анаболическими и антикатаболическими эффектами, повышением иммунитета, увеличением запасов гликогена в мышцах и др. Наряду с этим, показано, что дипептид является эффективным поставщиком аланина и глутамина[1,2,3] и таким образом опосредует разностороннее действие этих аминокислот соответствующее текущим потребностям организма.
Синтез белков осуществляется в организме постоянно и заменимая аминокислота α-L-аланин ( А- C3H7NO2 ) включается в состав многих белков и прежде всего мышечных, участвуя в обороте, практически непрерывно, на протяжении всей жизни. Способность аланина легко превращаться в глюкозу обуславливает функционирование глюкозо-аланинового цикла — одного из основных путей глюконеогенеза в печени. Аланин участвует в образовании мышечных белков, дипептида карнозин, коэнзима А, фермента аланинаминотрансферазы, пантотеновой кислоты (витамин В5). Всё это определяет основные физиологические задачи данной аминокислоты: поддержание баланса азота и постоянной концентрации глюкозы в крови. Эта аминокислота – один из важнейших источников энергии. В человеческом организме аланин образуется в мышечных тканях из молочной кислоты. При интенсивных физических нагрузках нехватка аланина стимулирует катаболические процессы в мышечных тканях. Аланин может образовываться и из других азотистых веществ или в процессе распада карнозина.
L-Глутамин (Г-C5H10N2O3 амидмоноаминодикарбоновой глутаминовой кислоты) является относительно незаменимой аминокислотой. Концентрация в крови составляет 500—900 мкмоль/л, что выше концентрации любой другой аминокислоты и является популярной аминокислотой для пищевых добавок, это один из наиболее известных кандидатов для коррекции работоспособности лиц, подвергающихся повышенным физическим нагрузкам, для оптимизации физиологических функций спортсменов, а также известное средство метаболитной терапии в клинике. Глутамин, будучи самой распространенной свободной аминокислотой в организме человека, наряду с глутаминовой кислотой, является предшественником пептидов, белков, нейротрансмиттеров, азотистых оснований и используется в качестве источника энергии различными органами, такими как кишечник. Эта аминокислота участвует в реализации многих функций, таких как поддержание пролиферации клеток (размножение клеток делением), регуляция иммунитета и клеточной активности, поддержание кислотно-щелочного баланса и регуляция экспрессии генов [4,5,6]. Помимо своей роли в качестве компонента белков, важен как глобальный транспортёр азота, осуществляет трансаминирование аминокислот и участвует образование новых аминокислот. Недостаток глутамина уменьшает пролиферацию ряда клеток и стимулирует апоптоз (запрограмированную гибель клетки). Введение глутамина, оказывает положительное влияние на метаболизм глюкозы, в том числе в состоянии резистентности к инсулину. Доказано, что дефицит L-Глутамина приводит к повышенной утомляемости, снижению мышечной силы, выносливости и внимания, к повышению времени реакции и ряду других нежелательных явлений, которые ухудшают работоспособность в целом и спортивные показатели в частности. Однако разносторонние исследования последних лет показали, что широкому применению L-Глутамина как отдельного продукта препятствуют особенности его физико-химических свойств, таких как: слабая растворимость и частичный распад в водной среде с выделением вредного газа аммиака, низкая термостабильность, выраженная зависимость от рН растворителя, неустойчивость в кислой среде.
В научной литературе представлен большой фактический материал об положительных эффектах L- Глутамина в диапазоне дозировок 0,2-0,4 г/кг/сутки у спортсменов и лиц, занимающихся регулярными физическими упражнениями, [7,8, 9,10 и др.].
В то же время, в ряде публикаций сообщалось, что не получено доказательств эффективности L-Глутамина в процессе тренировок, особенно у тренированных лиц, с высоко адаптивным нутритивным статусом [10, 11].
Можно думать, что эти различия связаны, прежде всего, с большой вариабельностью исследуемых групп лиц, различиями методических подходов, несопоставимостью регистрируемых параметров, а также с неустойчивостью L-Глутамина в кислотной среде желудка и другими факторами. Вместе с тем, глутамин применяется в клинической практике в качестве пероральной, парентеральной или энтеральной добавки в виде отдельной аминокислоты или в форме глутамин содержащих дипептидов, которые, как оказалось, имеют ряд достоинств по сравнению с ней. В частности, IPH AG и другие дипептиды проявляют большую физико-химическую устойчивость, обеспечивают лучшую доставку и в большем количестве в органы, ткани и межклеточное пространство глутамина и аланина. Так, растворимость в воде при комнатной температуре и стабильность в растворе существенно выше, чем у исходных свободных аминокислот аланина и глутамина, а также выше , чем у широко используемого в спортивной и клинической фармакологии дипептидов. Ранжированный ряд рассматриваемых веществ, составленный в порядке снижения их растворимости в воде.
Характеристики физико-химических свойств данных веществ крайне важны для оценки их фармакологических свойств и должны учитываться для прогноза усвояемости при том или ином пути введения в организм, оценки биораспределения в организме, расчёта дозировок ингредиентов и для корректного сравнения физиологической эффективности. Так, растворимость в воде L-Аланил-L-Глутамина в 15 раз выше, а L-Глицил-L-Глутамина примерно в 4 раза, чем L-Глутамина. Наряду с этим, выявлена неустойчивость L-Глутамина в водных растворах, низкая устойчивость в кислой ферментной среде желудка и относительно медленное и неполное всасывание в кишечнике (Таблица 1).
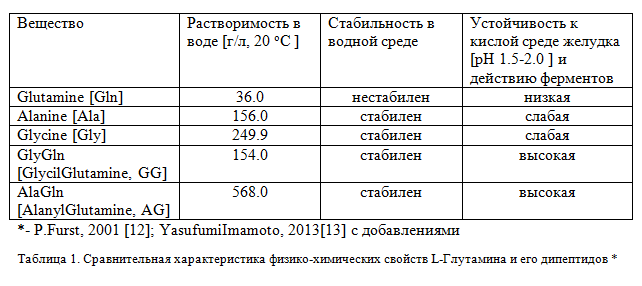
Установлено, что в течении первого часа при нормальной температуре тела разрушается порядка 50% введённого внутрь L-Глутамина, тогда как дипептид сохраняет стабильность не менее четырёх часов. Кроме того термостабильность дипептида намного выше, чем у глутамина, который при нагревании разлается с образование токсичного амиака. Эти и другие особенности, о которых будет сказано ниже, являются преимуществами дипептида как фармакологического средства. Так благодаря устойчивости дипептида в водных растворах , наряду с сухими, порошкообразными формами в виде (как правило сухие кристаллические порошки или чаще капсулированные формы , под наименованием L-Glutamine, созданы препараты в виде концентрированного 20% водного раствора для париентального питани , который предназначен для капельной внутривенной инфузии в центральные вены после добавления к совместимому инфузионному раствору. Доза зависит от тяжести гиперкатаболического состояния пациента и потребностей в аминокислотах. Рекомендуемая максимальная суточная доза для препарата составляет 2,5 мл/кг, что эквивалентно 0,5 г/кг чистого дипептида , т.е. 3,5 г/сутки для человека массой 70 кг. После введения дипептид быстро гидролизуется в плазме с образованием аланина и глутамина. Период жизни дипептида составляет 2.4-3.8 мин. Введение дипептида регулирует азотистый баланс и белковый обмен, поддерживает внутриклеточный пул глутамина, корригирует катаболическую реакцию, улучшает иммунную функцию, снижает частоту инфекционных осложнений, восстанавливает функцию кишечника [14].
Инфузия дипептида приводит к быстрому повышению концентрации глутамина и аланина в органах и тканях , прежде всего в мышцах и печени, во время всего периода инфузии и только следовые количества дипептида могут быть обнаружены в плазме.
Сравнительные исследования фармакокинетики при пероральном приёме дипептида и глутамина показали, что в эквивалентных по L-Глутамину дозах — дипептид (89 мг/кг) в большей степени, чем свободная форма L-Глутамина (60 мг/кг) , обеспечивает длительное и существенное повышение концентрации L-Глутамина в плазме крови. Исходная концентрации L-Глутамина составляет 475 ±108 мкмол/л. Через 30 минут приема L-Глутамина наблюдается возрастание концентрации аминокислоты максимально на 179 ± 61 мкмол/л с возвращением к исходным значениям через 2 часа. Среднее значение площади под кривой изменения концентрации (AUC) между 0 и 4 часами составило 127 ± 61 мкмол∙час∙л-1. После введения дипептида пик увеличения концентрации L-Глутамина в плазме составил +284 ± 84 мкмол/л (к базовым значениям), что на 59% больше, чем при введении L-Глутамина (P < 0,05). Длительность увеличения концентрации L-Глутамина также была больше в случае применения дипептида, а среднее значение AUC составило 284 ± 154 мкмол∙час∙л-1, что более чем в два раза превышает показатели при применении L-Глутамина (P < 0,05). В клиническом исследовании обнаружено, что приём дипептида внутрь не только превосходит свободную форму L-Глутамина по скорости всасывания в кишечнике более, чем в 2 раза, но и сохраняет эту способность при хроническом воспалении и пониженной секреции желудка. Такие особенности свойств указывают на перспективность практического применения дипептида в клинической и спортивной медицине [14,16 ].
В сравнительном плане дипептид более стабилен в ЖКТ, лучше всасывается в пищеварительном тракте и усваивается печенью при пероральном применении, чем свободный L-глутамин, часто применяемый внутривенно капельное в клиническом питании [17] .
Причём, при оральном применении дипептид более эффективен для повышения уровня глутамина в мышцах, чем эквивалентное количество глутамина. Это происходит из-за того, что после внутривенного введения дипептид быстро гидролизуются на молекулы А и Г, а после перорального введения молекула дипептида «работают» на месте в тонком кишечнике пищеварительного тракта, где происходит всасывание, далее небольшая часть молекул дипептида и свободных аминокислот транспортируется с лимфой в большой круг кровообращения, а основная часть с портальной кровью транспортируется в печень. Далее аминокислоты и короткие пептиды синтезированные организмом в печени транспортируются белками в другие ткани.
Интенсивные физические нагрузки являются мощным физиологическим стрессом, который в период действия стрессорного фактора ограничивает и даже выключает способность кишечника к полноценному всасыванию белков, жиров и углеводов, уменьшает их максимальный переносимый объем. Хронические интенсивные физические нагрузки часто ведут к целому ряду нарушений ЖКТ, особенно в тех видах спорта, которые требуют повышенной выносливости [18].
Поэтому дипептид IPH AG рекомендуют применять как перед длительной физической нагрузкой для улучшения всасывания электролитов и повышения выносливости, так и после интенсивных нагрузок для восстановления абсорбционной способности кишечника. Способ применения дипептида может быть подобен способу применения глутамина .
Следует отметить, что и аланин и глутамин являются важнейшими эссенциальными веществами. Так глутамин является наиболее распространенной аминокислотой в свободной форме в клетках человека и межклеточном пространстве. Глютамин синтезируется в организме человека в достаточном для нормального образа жизни количестве, однако, не являясь незаменимой аминокислотой, из-за ее центральной роли в глобальном метаболизме азота и участия в многих регуляторных и метаболических процессах считается условно незаменимой [19 , 20 ].
Помимо своей роли в качестве наиболее распространённого компонента белков и важности в трансаминировании аминокислот, глутамин является важным компонентом различных метаболических процессов. Глутамин метаболизируется практически во всех органах и тканях и может быть классифицирован как истинный регулятор аминокислотного баланса.. Во внеклеточной жидкости, глутамин составляет около 25%, а в скелетных мышцах более 60% от всего пула свободных аминокислот. Трансмембранный концентрационный градиент в мышцах составляет около 34:1 [внутриклеточная/внеклеточная жидкость]. Концентрация свободного глутамина сильно варьирует в различных органах и тканях. Важно, что в плазме крови содержится только очень небольшая часть свободного глутамина находящегося в организме и концентрация этой аминокислоты в плазме не зависит прямо от внутриклеточной концентрации, поэтому концентрация глутамина в плазме не может служить маркером содержания глутамина в организме в целом [26]. Общее содержание глутамина в организме главным образом определяется долей этой аминокислоты в составе белка: 4,3±0,6 г на 100 г белка мышечной ткани. Мышцы представляют собой основной эндогенный источник глутамина. С учетом того, что мышцы составляют 40% от веса тела, считается, что общее содержание глутаминав мышцах у мужчины массой 70 кг примерно 240-280 г [2,12].
При экстремальных нагрузках или критических патологических состояниях свободный глутамин истощается очень быстро, организм компенсирует уровень свободного глутамина прежде всего за счет распада белков мышечной ткани и повышенного синтеза глутамина. Причина развития дефицита глутамина – большое количество метаболических реакций и функций, которые прямо или косвенно зависят от глутамина, а также высокая и резко возрастающая потребность в нём у быстро растущих клеток.
Кроме того, глутамин служит межорганным транспортером азота в организме. Примерно 1/3 всего азота транспортируется в крови в виде глутамина [21]. Эндогенные резервы глутамина и возможности его синтеза d таковы, что в условиях истощающих нагрузок или агрессивного стресса сравнительно быстро развивается относительный дефицит Глютамина.
Большая часть азота, потребляемого мышцами, используется в мышечных клетках для синтеза глутамина, который является нетоксичным переносчиком аммония из периферических тканей к внутренним органам. Глутамин – главный субстрат для синтеза мочевины в печени и аммониогенеза в почках. В митохондриях с участием глутаминазы глутамин может превращаться в глутамат с образованием аммония. Глутамин, как межорганный переносчик азота, имеет важное значение в экскреции продуктов белкового обмена [мочевины, креатинина, мочевой кислоты, пуриновых оснований, др.] и поддержании кислотно-основного гомеостаза организма. В почках с участием почечного изофермента глутаминазы глутамин используется для аммониогенеза с потреблением ионов Н+.
Кроме того, следует отметить, что обе аминокислоты жизненно важны не только для обмена азота между тканями, но и производства и / или хранения глюкозы. Причём функции аланина и глутамина реализуются не просто параллельно, но они часто взаимосвязаны и синергетичны: аланин является наиболее важной аминокислотой, участвующей в переносе азота из мышц в печень. Оказавшись там, углеродный скелет аминокислоты может быть преобразован в глюкозу как часть глюкозо-аланинового цикла [22].
Обе аминокислоты также улучшают гидратацию синергетическими способами. Аланин влияет на гидратацию и объем клеток, повышая внутриклеточные концентрации калия , тем самым втягивая воду в клетку. Глутамин также влияет на объем клеток, помогает поддерживать общий кислотно-щелочной баланс организма, потому что аммиак, который отщепляется от аминокислоты и доставляется в почки, влияет на транспорт воды. В ответ на тяжелые физические нагрузки или другие формы физиологического стресса обе аминокислоты высвобождаются из мышц в значительных концентрациях. Если концентрации этих аминокислот в мышцах не восстанавливаются, то может снизиться устойчивость к физической нагрузке, торможение восстановления, снижение функций иммунной системы, роста мышц, развиться общая гипофункция. Здоровые люди весом около 70 кг имеют от 70 до 80 г относительно свободного глутамина, распределенного по всему организму. В количественном отношении скелетные мышцы являются наиболее значимым пулом запаса глутамина[23]. Используя изотопные и фармакокинетические методы, было установлено, что эндогенная продукция глутамина составляет от 40 до 80 г / день [24-26]. В плазме, полученной из образцов крови, концентрация глутамина колеблется от ~ 500 до 800 мкМ / л [значения, зарегистрированные через 12 ч в состоянии натощак], что составляет около 20% от общего пула свободных аминокислот в крови [27]. В тканях, таких как печень и скелетные мышцы, концентрация глутамина даже выше, чем в плазме, что составляет около 40-60% от общего пула аминокислот . Как в плазме, так и в тканях особенно мышечной, концентрация глутамина в 10-100 раз превышает любую другую. Общий резерв мышечного запаса глутамина относительно мал [у человека массой 70 кг около 240 г], стресс-индуцированный распад 1 кг мышечной ткани обеспечивает только 9 г глутамина, поэтому катаболический выброс глутамина ограничен и недостаточен при длительно продолжающихся нагрузках истощающего действия [23].
Таким образом, скелетные мышцы играют критическую роль в метаболизме глутамина, поскольку мышцы являются одной из наиболее распространенных тканей в организме человека [28]. Внутримышечное содержание глутамина соответствует 50–60% от общего количества свободных аминокислот в тканях скелетных мышц. Приблизительно 80% глутамина в организме содержится в скелетных мышцах, и эта концентрация в 30 раз выше, чем в плазме человека [29,30]. Концентрация свободных аминокислот в мышечной ткани зависит от типа мышечного волокна. Исследования, проведенные на скелетных мышцах крыс, показали, что концентрация глутамина была в три раза выше в медленных мышечных волокнах [волокна типа 1], чем в быстрых мышечных волокнах [волокна типа 2]. Высокая концентрация глутамина в медленно сокращающихся мышечных волокнах обусловлена высокой активностью фермента GS и доступностью АТФ для синтеза глутамина[31].
Глутамин является важным источником углерода и азота для различных субстратов организма и используется непосредственно для синтеза белка и служит как предшественник для синтеза других аминокислот. Глютамин донатор азота для синтеза аминосахаров, пуринов и пиримидинов, используемых для синтеза азотистых оснований, входящих в состав дезоксирибонуклеиновой [ДНК] и рибонуклеиновой [РНК] кислот, необходимых для пролиферации клеток и синтеза белков[32].
При критических напряжения происходит функциональное перераспределение снабжения органов пластическими и энергетическими ресурсами, развиваются состояния гиперкатаболизма и гиперметаболизма нарушается баланс между продукцией и потреблением глутамина. Тонкая кишка – главный орган, потребляющий глутамин. При стрессе, использование глутамина кишкой возрастает, что усиливает его дефицит.
Сегодня доказано, что глутамин является абсолютно необходимым субстратом для поддержания структуры и функции кишки [33, 34] особенно при состояниях, когда происходит повреждение слизистой оболочки кишки, ухудшение барьерной функции и, следовательно, увеличение степени транслокации бактерий и токсинов в кровоток [33–35]. Если гиперкатаболизм не корригируется, то повышается риск развития полиорганной недостаточности. Высказываются предположения [34], что повышенное потребление глутамина при стрессе позволяет сэкономить глюкозу для органов, которые облигатно используют ее для энергии: мозг, эритроциты, костный мозг и грануляционная ткань.
Показано, что быстро делящиеся клетки, в том числе клетки слизистой оболочки кишки, поджелудочной железы, легочных альвеол и клетки иммунной системы, используют глутамин для энергетических и пластических нужд. Глутамин – главный источник энергии для клеток желудочно-кишечного тракта (энтероциты, колоноциты) [33]. Физиологическое состояние тонкого кишечника очень важно для усвоения веществ прежде всего белковой природы, поскольку именно в этом отделе ЖКТ довершается кислотная деградация полипептидных молекул, происходит их ферментативная гидратация и всасывание: олигонуклеотидов, коротких пептидов (трипептидов, аланил-глутамина и других дипептидов), а также аминокислот [рис.1]. Важную роль в расщеплении и всасывании пептидов играют каемчатые энтероциты, находящиеся на ворсинках эпителия кишечника. Эти клетки задействованы почти на всех этапах пищеварения, включая пристеночное и мембранное.
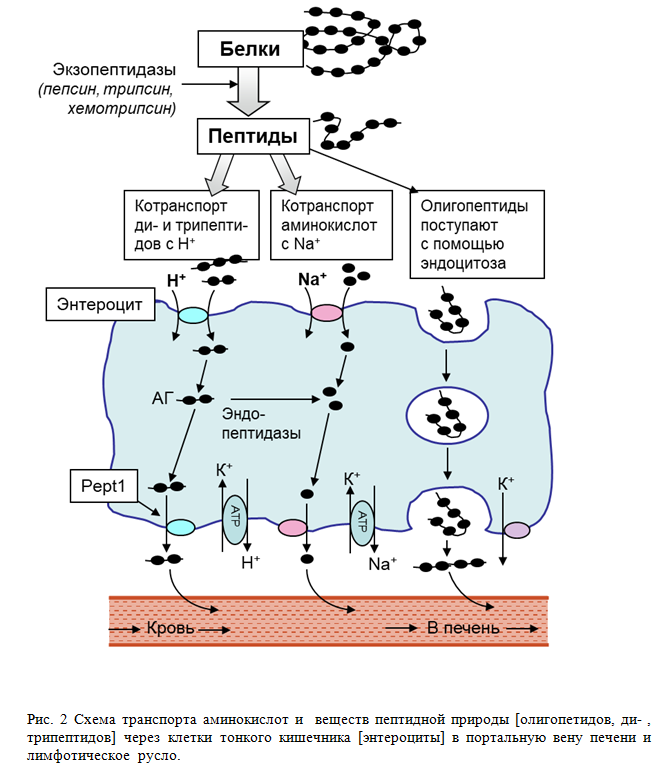
Транспорт дипептида осуществляется протон [Н+]-связанным котранспортером РерT1
В настоящее время установлено, что полипептиды расщепляются под кислотным и ферментативным воздействием в просвете кишечника до коротких пептидов , состоящих из двух-трех аминокислот и до свободных аминокислот. Образующиеся ди- и трипептиды накапливаются в значительных количествах в цитозоле клеток (энтероцитах) слизистой кишечника, ди-три и тетропептиды способны сохраняться при цитозольном гидролизе и транспортироваться неповрежденными через базолатеральную мембрану, присоединяясь к транспортному белку РерT1 – протон [Н+] -связанному котранспортеру [36]. Попадая главным образом в венозную кровь портального кровотока и далее в печень, а также в лимфу. Т. о. при пероральном или энтеральном введении дипептид действует локально в желудочно-кишечном тракте как для защиты целостности слизистой оболочки кишечника, так и для поддержания барьерных функций кишечника. Эти эффекты являются основой положительного влияния короткого пептида – поддержание или/и восстановление интегративной функции кишечника, нормализация абсорбции нутриентов, предупреждение и торможение возможности развития синдрома истощения (увеличение тощей массы тела – ТМТ), коррекция баланса обмена веществ усилением анаболических и торможением катаболических процессов в мышечной, лёгочной и нервной тканях.
В этой связи, среди «срочных эффектов» дипептида , обосновано выделяют действия связанные с ускорением процессов регидратации организма при высоких продолжительных нагрузках — наблюдается сохранение работоспособности в течение более длительного времени и с высокой эффективностью. Кроме того, пептид обеспечивает значимое эргогенное преимущество за счет увеличения времени переносимости физических нагрузок в условиях умеренного гипогидратационного стресса [37-40].При этом в ряде работ отмечается, что пептид не только превосходит свободную форму L-глутамина по скорости всасывания в кишечнике более, чем в два раза, но и сохраняет эту способность при системном хроническом воспалении и пониженной секреции желудка. В целом, такие особенности действия могут иметь непосредственное практическое значение для применения дипептида в клинической и спортивной медицине.
В ряде исследований установлено, что быстроделящиеся клетки, в том числе клетки слизистой оболочки кишки, поджелудочной железы, легочных альвеол и клетки иммунной системы, используют глутамин для энергетических и пластических нужд. А для клеток желудочно-кишечного тракта [энтероциты, колоноциты] глутамин является главным источником энергии [33, 41].
При внутриклеточном окислении глутамина образуется АТФ -наиболее важная молекулярная форма сохранения и использования химической энергии в клетках., общее количество запасаемой энергии зависит от доступности глутамина и степени его окисления. При стрессе это определяется главным образом уровнем дефицита глутамина, доступностью глюкозы как альтернативного источника энергии в некоторых тканях и фазы жизненного цикла клетки. Например, лимфоциты используют глутамин для энергии в большей степени после митогенной стимуляции [41]. В физиологических условиях, окисление глутамина дает около 1/3 энергии в быстро делящихся клетках [42], при сильном стрессе и патологических реакциях окисление глутамина может увеличиваться.
Функционирование иммунной системы также зависти от доступности глутамина. Стресс, вызывая дефицит глутамина, нарушает функцию иммунной системы. Потребление глутамина клетками иммунной системы увеличивается в 10 раз по сравнению с другими клетками.
Функционирование иммунной системы также зависти от доступности глутамина. Катаболический стресс, вызывая дефицит глутамина, нарушает функцию иммунной системы. Показано, что потребление глутамина пролиферирующими клетками иммунной системы увеличивается в 10 раз по сравнению с другими клетками [43, 44,45].
Глутамин является незаменимым субстратом для нормального функционирования гуморального и клеточного иммунитета. Так, исследования in vitro показали, что недостаток глутамина в среде тканевой культуры резко ограничивает способность лимфоцитов отвечать на митогенную стимуляцию [46]. Кроме того, некоторые медиаторы воспаления [интерлейкины и др.] и глюкокортикоиды повышают активность глутаминазы лимфоцитов, в том числе в мезентериальных лимфатических узлах, что приводит к усилению утилизации Г.
Следовательно, употребление уникального экзогенного кишечного транспортера в виде молекулы дипептида может покрывать возможный относительный дефицит и более эффективно увеличивать резервное количество глутамина в кровотоке, межклеточном пространстве, в скелетных мышцах и клетках по сравнению с обычным свободным Глютамином. При введении пептида поддерживается более высокий уровень концентрации в кампартментах глутамина: плазме крови, лимфе, межклеточном пространстве и скелетных мышцах, по сравнению с введением свободного глютамина. Эта особенность биораспределения очень важна, поскольку до 65% вводимого оральным путём свободного Глютамина может быть уничтожено, прежде чем он достигнет мышц. Можно предполагать, что в здоровом организме существует многопараметрический динамический гомеостаз глутамина, он сбалансирован и настроен таким образом, что поддерживается неустойчивое резервное количество Глютамина. Текущие потребности удовлетворяются за счёт резерва и выброса глутамина из мышц и легких путём распада собственных белков, а пополнение запаса идёт за счёт поступлений извне и повышения синтеза глутамина denovo. Глютамин активно расходуется прежде всего на поддержание нормальной структуры. и функции слизистой оболочки кишки, печеночного аммониогенеза, пролиферацию лимфоцитов, других клеток иммунной системы, работу мышц. Снижение внутримышечной концентрации глутамина вызывает значительное усиление распада мышечных белков. Общий мышечный запас глутамина относительно мал (около 240 г), стресс-индуцированный распад 1 кг мышечной ткани обеспечивает только 9 г глутамина, поэтому катаболический выброс глутамина ограничен и недостаточен при возрастающих потребностях. Во время катаболического стресса у пациента с массой тела 70 кг потребление глутамина слизистой оболочкой кишки, почками и иммунной системой выше, чем организм может компенсировать путем распада собственных мышц и повышенного синтеза глутамина, примерно на 12 г/сут. Реальная потребность в глутамине при стрессе и экстремальных нагрузках не менее 18-22 г/сут [45].
Гипофункция скелетных мышц и непереносимость физических нагрузок являются отличительными клиническими признаками пациентов с сердечной недостаточностью, ишемической болезни сердца (ИБС) и другими патологиями сердечно сосудистой системы (ССС). Как правило, они в большей или меньшей степени связаны с прогрессирующим катаболическим состоянием, воспалением скелетных мышц и нарушением окислительного метаболизма. На протяжении продолжительного периода врачи-исследователи, специалисты спортивной медицины разных стран уделяют значительное внимание поиску средств оптимизации работы ССС при высоких нагрузках, лекарств против ИБС и сердечной недостаточности, продуктов специального спортивного питания. В ходе поисков, в частности установлено, что полиненасыщенные жирные кислоты (ПНЖК), такие как омега-3, омега-6, омега-9 и другие (более 11) влияют на обмен веществ в организме, в том числе на клеточном уровне. Оказалось , что ПНЖК не синтезируются в тканях организма, но необходимы для его жизнедеятельности. В частности ПНЖК защищают клетки от преждевременного старения, помогают сохранить их генетическую информацию. Регулируют жировой обмен и жизнедеятельность полезных бактерий, обитающих в кишечнике. В 2004 году FDA (Управление по контролю за продуктами и лекарствами США) признало, что потребление некоторых из омега-3-ПНЖК (эйкозапентаеновая кислота [ЭПК], докозаланил-глутаминексаеновая кислота [ДГК]) могут снизить риск развития ишемической болезни сердца. В организме перекисному окислению ПНЖК противодействуют антиоксидантные системы, включающие трипептид глутатион, который синтезируется из глутамина [47-52].
Было показано, что пищевые добавки, включая рыбий жир, содержащий полиненасыщенные жирные кислоты омега-3ПНЖК, эйкозапентаеновую кислоту [ЭПК] идокозаланил — глутаминексаеновую кислоту (ДГК), снижают смертность у больных с хронической сердечной недостаточностью [52].
Влияние ПНЖК проявлялось улучшением показателей сердечной функции, толерантность к физической нагрузке и уровни циркулирующих цитокинов [TNFα, IL-1 и IL-6] у пациентов с хронической стабильной сердечной недостаточностью [53].
Сверх того, как уже отмечалось выше, Глютамин не только участвует в поддержании гомеостаза азотного баланса за счет изменения интенсивности протеолиза мышц, но также в поддержании синтеза мощного антиоксиданта и регулятора целостности клеточных мембранглутатиона, вероятно предупреждающего быстрое окисление ПНЖК [55-58].
В слепых, рандомизированных клинических исследованиях у пациентов с прогрессирующей сердечной недостаточностью [СН], которая вызывалась прогрессирующим развитием метаболических нарушений, воспалениями и атрофией в миокарде и в скелетных мышцах, показано, что наблюдается четкий метаболический переход от использования в норме жирных кислот к использованию глюкозы в качестве основного энергетического субстрата для генерации АТФ в цикле трикарбоновых кислот (ЦТК). Предполагается, что это переключение является результатом изменений в генетической программе со снижением экспрессии ферментов карнитин-пальмитоилтрансферазы (СРТ) -1, ацил-КоА-дегидрогеназы со средней длиной цепи (MCAD), цитрат-синтазы и следовательно использования ПНЖК [55,58].
Это метаболическое переключение наблюдается в скелетных мышцах с увеличенными (гликолитически) мышечными волокнами II типа и уменьшенными (окислительно) волокнами I типа [60]. Предполагается, что этот внутренний метаболический переход в скелетных мышцах способствует развитию непереносимости физических нагрузок.
В исследовании [55] пациенты длительно (1 и 3 месяца) получали внутрь либо комбинацию пептидного комплекса день и рыбьего жира [источник ПНЖК] 6,5 г / день, либо комбинацию сафлорового масла и сухого молока (плацебо) в эквивалентных по калорийности количествах. Исследования установили, что комбинированная добавка дипептида и ПНЖК улучшали тестируемую физическую нагрузку, свойства мышц (по анализу биоптата) или функцию мышц, и увеличивали мышечную массу тела и улучшали качество жизни у пациентов с хронической стабильной сердечной недостаточностью. Эти и другие данные указывают на потенциальную полезность эффектов высоких доз ПНЖК и эффективность одновременного действия дипептидной добавки у пациентов с хронической стабильной сердечной недостаточностью [61-62]. Вопрос о механизмах взаимодействия и положительного влияния дипептида и ПНЖК на рост мышечной массы остаётся важным и дипептиды являются транспортёром жирных кислот в клетку, действует опосредованно путём влияния на агрегацию цепочек молекул жирных кислот с формированием мицелл и тем облегчая их абсорбцию в кишечнике, и влияет на усвоение и биосинтез других физиологически активных веществ внутри клеток.
Клеточные механизмы действия ПНЖК интенсивно исследуются, но пока еще не определены, однако считается, что омега-3 эйкозапентаеновая кислота (ЭПК), докозаланил-глутаминексаеновая кислота (ДГК) могут действовать как непосредственно, так через метаболиты, такие как эйкозаноиды [61,62].
В связи с этим, есть основание вероятной сферой управляющего воздействия дипептида на процессы катаболизма и усвоения ПНЖК рассматривать механизмы модуляции окисления жирных кислот в межклеточном пространстве, в пределах клеточных мембран и в клеточном цитозоле глутатионом. Трипептид глутатион является мощным системным антиоксидантом, прогностически способным влиять на утилизацию ПНЖК. В настоящее время присутствуют научные подтверждения прямого влияния потребления ПНЖК на работоспособность и уровень физической готовности атлетов, однако некоторые из выявленных свойств омега-3 и омега-6 ПНЖК, указывают на возможность прямого или опосредованного положительного влияния жирных кислот на функцию ряда органов и систем в процессе тренировок, ускорять восстановление, снижать при кратковременном или продолжительном приеме последствия повреждений мышц и связок, уменьшать воспаление, стабилизировать показатели сердечно-сосудистой и дыхательной систем в покое и при нагрузках. Дипептид благоприятствует такому действию ПНЖК [63-66].
В свою очередь, глутамин играет важную роль в регуляции синтеза глутатиона. Показано, что глутамин, усиливая образование глутатиона, вызывает клеточные анаболические эффекты за счет увеличения объема клеток. При стрессе, когда в некоторых тканях повышено содержание свободных радикалов, повреждающих клетки, потребность в глутамине увеличивается [67].
Экспериментально на животных показана возможность прямого влияния потребления пищи обогащённой пептидным биорегуляторм на повышение уровня глутатиона (GSH) в сыворотке крови и ткани печени. Изучалась связь между дипептидом и биосинтезом глутатиона (GSH), роль этой связи в защите печени. Использовали двадцать самцов крыс линии Вистар, они были случайным образом разделены на две группы: одна получала стандартное парентеральное питание [ЗППП], а другая — с добавлением или без дипептида в течение 7 дней. Образцы крови и ткани печени исследовали после перитонеальной инъекции гепатотоксина 5-фторурацила [5-FU]. Оказалось, что концентрация глутатиона (GSH) в сыворотке крови была достоверно выше в группе принимающих дипептид , чем в группе с ЗППП и содержание GSH в ткани печени было на 36,2% выше, чем в группе с стандартным питанием, Крысы в группе дипептид имели меньшее повышение печеночных ферментов после введения 5-FU, что указывает на гепатопротективное действие дипептида. Т.е. стандартная пища дополненная пептидным комплексом может защитить функцию печени путем увеличения биосинтеза глутатиона и сохранения запасов глутатиона в печеночной ткани [68].
Восстановленный глутатион (GSH) – трипептид, состоящий из аминокислот L-глутамата, L-цистеина и глицина, это наиболее эффективный антиоксидант поддерживающий внутриклеточный окислительно-восстановительный потенциал [или редокс-потенциал], который представляет собой отношение восстановленной о окисленной (GSSG) форм глутатиона (GSH/GSSG). Поддержание оптимального соотношения GSH>>GSSGв клетке является критичным для нормального ее функционирования и выживания. Система глутатиона является ловушкой свободных радикалов, в частности предупреждает развитие внутриклеточного окислительного стресса. GSH защищает клетки от повреждений, вызванных производством в процессе физических нагрузок свободных радикалов, особенно, когда их уровни превышают возможности организма защищаться от таковых. Недостаток GSH подвергает клетку риску окислительного повреждения [69-71].
Глутатионовая система редокс — потенцила не только обеспечивает устойчивость клеток к окислительному стрессу, но участвует в механизмах утилизации полиненасыщенных жирных кислот с последующим синтезом цитокинов и эйкозаноидов. Эйкозаноиды это окисленные производные полиненасыщенных жирных кислот — эйкозотриеновой (С20:3), арахидоновой (эйкозотетраеновая, С20:4) , тимнодоновой (эйкозопентаеновая, С20:5) . Эйкозаноиды синтезируются из омега-3 [ω-3] и омега-6 [ω-6] жирных кислот. В целом, омега-6 эйказаноиды являются провоспалительными. Пищевыми источниками полиненасыщенных жирных кислот являются растительные масла, рыбий жир и препараты омега-3-жирных кислот. Эйкозаноиды участвуют во множестве процессов, таких как рост мышечной ткани, раздражение и реакциях иммунитета на введенные токсины и патогены. Эйкозаноиды образуются почти во всех клетках организма. Но GSH глутатион сравнительно быстро истощается, особенно в условиях дефицита глутамина, а восстанавливается сравнительно медленно [72-75].
Особенно интенсивно глутатион расходуется в почках, в печени, слизистой кишечника и макрофаланил-глутаминах. Период полуобновления GSH [T1/2] в плазме крови равен 2 мин; в почках 30-50 мин, в печени, слизистой кишечника и макрофаланил-глутаминах 2-3 ч; в головном мозге; эритроцитах, селезенке, легких 2-4 суток; в хрусталике глаза 2-8 суток [76] .
Можно ожидать, что дипептид не только может влиять на усвоение и утилизацию полиненасыщенных жирных кислот, синтез цитокинов и эйкозаноидов, синтез глутатиона, но и в качестве поставщика глутамина на синтез жирных кислот и мембранных фосфолипидов протекающих с участием метаболитов глутамина, в том числе субстрата цикла Кребса ацетил-кофермента А, предоставляющим ацетильные группы. Считается, что поступление глутамина в клетки мышц и печени повышает их гидратацию, и служит как анаболический пролиферативный сигнал [77]. Оральное введение дипептида может изменить весь метаболический ответ организма на стресс. Пептидный биорегулятор может также использоваться для коррекции энергетического обмена: как для улучшения глюконеогенеза в печени так и для депонирования глюкозы в виде гликогена. Кроме того при внутриклеточном окислении глутамина образуется АТФ, что может рассматриваться в качестве альтернативного источника энергии при высоких нагрузках.
Разработка компанией инновационного высококачественного пептидного комплекса IPH AG и внедрение его в течение последних лет в практику спортивной и клинической медицины расширило возможности предупреждения и срочной фармакотерапевтической коррекции нарушенных перегрузками функций, ускоряя процессы регидратции воды и электролитов, повышает последующее усвоение макро- и микронутриентов, а также осуществляет восполнение относительной недостаточности L-глутамина при экстремальных физических нагрузках, которые в период действия стрессирующего фактора ограничивают или выключает способность кишечника к полноценному всасыванию органических и минеральных веществ. Хронические интенсивные физические нагрузки, без адекватного питания, метаболитной коррекции и режима релаксации, ведут к ряду нарушений ЖКТ и снижению иммунитета жира [78-82]. Благодаря своим исключительным физико-химическим и биохимическим свойствам, IPH AG показан для формирования условий адекватной нутритивной поддержки [предшествующее, текущее и последующее питание] с целью предупреждения угрозы развития недостаточности питания или снижения усвоения нутриентов, стимулировать увеличение тощей массы тела (ТМТ) и снижение отложения жира . Производимый компанией высококачественный пептидный комплекс , не содержит примесей, высокоэффективен и действует в низких дозах. Таким образом IPH AG способен поддерживать большой спектр физиологических функций и может стать одним из лучших средств предупреждения и/или устранения дефицитарных состояний. Наряду с этим, являясь средством метаболитной направленности действия , IPH AG перспективен и в качестве средства поддержания нормальной иммунной функции, клеточных энергетических процессов в возбудимых тканях, протективного средства, способного противодействовать влиянию физиологического и патологического стресса. Прогностически IPH AG будет востребован в спортивной и клинической медицине, а также у широкого круга лиц в качестве практически безопасного мягкого адаптопротективного и адаптогенного средства для повышения устойчивости человека к экстремальным нагрузкам.
ЛИТЕРАТУРА
- А. Дмитриев, А. Калинчев. SportWiki энциклопедия. sportwikito
- С.Н. Ложкин, А.Д. Тиканадзе, М.И. Тюрюмина. Вестник интенсивной терапии. — №4. -2003. — С. 64-69.
- A.A.Lima, G.H.Carvalho, A.A.Carvalho.Nutrition 2002, 18:458-462.
- J. T. Brosnan. The Journal of nutrition. — 2003. — Vol. 133, no. 6 Suppl 1. — P. 2068—2072.
- P.Brosnan, J.Procopio J., M.M.Lima, T.C. Pithon-Curi, R.,Curi. Cell BiochemFunct. 2003;21: 1–9.
- H.Newsholme, F. Abdulkader, E. Rebelato , T. Romanatto, Pinheiro CEJ, R.F. Vitzel. FrontiersinBioscience, 2011; 16: 315–319.
- J. Antonio ,C. Street. Canadian Journal of Applied Physiology.1999, 24[1]: 1-14.
- J.L.Bowtell,K. Gelly , M.L.Jackman . J. Appl. Physiol. 1999, 86[6]:1770-1777.
- M. Hakimi ,M.A.Mohamadi, Z. Ghaderi. J.Human Sport and Exercise. 2012, 7[4]
- M. Williams .Dietary J. Int. Soc. Sports Nutr. 2005, 2[2]: 63–67.
- M. Gleeson .J.Nutr., 2008, 138[10]: 2045S-2049
- P. Furst. J.Nutr., 2001, 131[9]: 2562S-2568S.
13.YasufumiImamoto,Hisaya Tanaka, Ken Takahashi, Yoshinobu Konno, and Toshiyuki Suzawa.Cytotechnology. 2013 Jan; 65 [1]: 135–143.
- Дипептивен [Dipeptiven] инструкцияпоприменениюпрепарата, датаобновления: 2011.08.23. РЛС
- Аланилглутамин [СУСТАМИН]: Инструкция по применению. Интернетресурс
16.P. Klassen, M. Mazariegos ,N.W.Mohamadi, P. Furst. The J.of Nutrition [American Society for Nutritional Sciences], 2000, 130:177-182
- A.A.Lima , G.H. Carvalho, A.A. Figueiredo. Nutrition. [2002], 18:458–462.
- E.P. de Oliveira ,R.C.Burini, A. Jeukendrup . Sports Med. 2014 May;44 Suppl 1:S79-85.
- P. Furst, K. Pogan, and P. Stehle. Nutrition 1997,13:731-737.
- J. Wernerman, 2004. Clin. Nutr. Suppl. 1:37-42.
21 W.W. Souba .J.P.E.N. 11:569, 1987
- Е.С. Северин, Т.Л. Алейникова, Е.В. Осипов, С.А. Силаева. Биологическаяхимия, М. 2008, 364 с.
- E.A.Newsholme, M. Parry-Billings. J. Parenter. Enter. Nutr. 1990;14:63S–67S. doi: 10.1177/014860719001400406.
- J. Wernerman. J. Nutr. 2008;138:2040S–2044S.
- A. Berg , A. Norberg, C.R.Martling,L. Gamrin , O. Rooyackers, J. Wernerman.Intensive Care Med. 2007;33:660–666.
26.B.I. Labow, W.W. Souba, S.F. J. Nutr. 2001;131:2467S–2486S.
- E. Roth .J. Nutr. 2008;138:2025S–2031S.
- J. Tirapegui,V.Cruzat.In: R. Rajendram ,V.R.Preedy, V.B. Patel , editors. Glutamine in Clinical Nutrition. Springer; New York, NY, USA: 2015. pp. 499–511.
- V.F. Cruzat ,J. Tirapegui . Nutrition. 2009;25:428–435.
- N.P. Walsh ,A.K. Blannin, P.J. Robson , M. Gleeson . Sports Med. 1998;26:177–191.
- D.G. Rowbottom , D. Keast , A.R. Morton .Sports Med. 1996;21:80–97. doi: 10.2165/00007256-199621020-00002.
32.S. Yoshida ,T.Yunoki , K. Aoyagi, J. Ohta , N.Ishibashi ,T.Noake , T. Kakegawa. J. Surg. Res. 59:475, 1995
33.B. Darcy-Vrillon ,L. Posho , M.T. Morel, F. Bernard , F. Blachier F, J.C. Meslin, P.H.Duée. Pediatr. Res. 36:175, 1994
- W.W.Souba, D.W.Wilmorc.Arc. Surg. 120:66, 1985
- LaDing, Li JS. World J Gastroenterol. 2003 Jun;9[6]:1327-32.
- W.M. Miner-Williams , B.R. Stevens, P.J. Moughan. Nutr Res Rev. 2014 Dec;27[2]:308-29.
- C.R.Harris, J.R.Hoffman, A.Allsopp, N.B.H. Routledge. Nutrition Research, 2012, 1-6
- J.R.Hoffman, H.Stavsky, B. Falk. Int. J. Sports Med. 1995, 16:214-218.
- J.R.Hoffman, N.A.Ratamess, J.Kang, N.Kelly, A.M.Gonzalez, M. Stec, et al. J.Intern.Soc.Sports Nutrition. 2010, 7:8-20.
- J.R.Hoffman, N.A.Ratamess, J.Kang S.L. Rashti.. Kinesiology, 2011, 43[2]:125-136.
- K. Brand, FeklW., J. von Hintenstern, K. Langer, P. Luppa and C. Schoemer. Metabolism 1989. 38:29-33.
42.Z. Spolarics ,C. H. Lang, G. J. Bagby, J. J. Spitzer. Am. J. Physiol. 261:G185, 1991
- K. Brand.Biochem. J. 228:353, 1985
- K. Brand, W. Leibol, P. Luppa, C. Schoerner, A. SchulzImmunobiology 1986.173:23
- https://himija-online.ru/wp-content/ — интернетресурс
- N. Piccirillo, S. De Matteis, L.Laurenti, P. Chiusolo, F. Sorà, M.Pittiruti, S.Rutella, S.Cicconi, S.Sica.Haematologica. 2003 Feb;88[2]:192-200.
- B.Levine , J. Kalman , L. Mayer , H.M. Fillit, M.P. Packer . The New England journal of medicine. 1990;323:236–241. [PubMed] [Google Scholar]
- A.Chokshi , K. Drosatos , F.H. Cheema , Ji R, T.Khawaja , Yu S, T. Kato , R. Khan , H.Takayama ,R. Knoll , H.Milting , C.S.Chung , U. Jorde , Y. Naka , D.M.Mancini, I.J.Goldberg , P.C. Schulze. Circulation. 2012;125:2844–2853.
- W.Doehner ,M. Rauchhaus , P. Ponikowski , I.F. Godsland , von Haehling S, D.O.Okonko , F. Leyva , A.J.Proudler , A.J. Coats, S.D.Anker . J. Am Coll Cardiol. 2005;46:1019–1026.
5O. H. Drexler ,U. Riede , T. Munzel , H. Konig , T.Funke, H. Just.
Circulation. 1992;85:1751–1759.
- R.Hambrecht,P.C. Schulze, S. Gielen , A.Linke , S. Mobius-Winkler S, Yu J, J.J. Kratzsch , G. Baldauf , M.W. Busse, A. Schubert , V. Adams , G. Schuler. J.AmCollCardiol. 2002;39:1175–1181
- H.FGissi., L.Tavazzi L, A.P.Maggioni, R.Marchioli, S.Barlera, M.G.Franzosi. Lancet. 2008;372:1223–1230.
- S.Nodari , M. Triggiani , U. Campia , A. Manerba, G.Milesi , B.M. Cesana. J Am Coll Cardiol. 2011;57:870–879.
- G.Smith, P.Atherton, D.N.Reeds, B.S.Mohammed, DRankin., M.J.Rennie, B.Mittendorfer. The American journal of clinical nutrition. 2011;93:402–412.
- K.Shahzad , A. Chokshi , P.C. Schulze.Current clinical pharmacology. 2011;6:288–294.
- J.M.,Engel,J.Muhling , M.Kwapisz , M.Heidt. Acta anaesthesiologicaScandinavica. 2009;53:1317–1323.
- V. Carubelli ,A. Castrini , V. Lazzarini , M.Gheorghiade , M. Metra, C.Lombardi. Heart Fail Rev. 2015;20:39–51.
- G.S.Francis, B.H. Greenberg, D.T.Hsu, B.E. Jaski, M. Jessup , M.M. LeWinter , F.D.Pagani , I.L.Pina, M.J. Semigran, M.N. Walsh, D.H. Wiener, C.W.Yancy. Circulation. 2010;122:644–672.
- B. Levine, J.Kalman , L.Mayer, H.M. Fillit, M.P.Packer. The New England journal of medicine. 1990;323:236–241.
- B.S. Christina Wu, T. S. Kato, Ji. Ruiping, Cynthia Zizola.
Circ Heart Fail. 2015 Nov; 8[6]: 1077–1087.
- Jump DB, Depner CM, Tripathy S. Omega-3 fatty acid supplementation and cardiovascular disease. JLipidRes. 2012;53:2525–2545.
- R.T.Holman. J Nutr. [1998]128 [2]: 427S–433S.
- “Editorial: Are PUFA harmful?”. Br Med J. 4 [5883]: 1–2. 1973. PMID 4755208.
- M. E.Jørgensen,P. Bjeregaard , K.Borch-Johnsen . Diabetes care. — 2002. — Vol. 25, no. 10. — P. 1766—1771
- Christina Wu, Tomoko S Kato, Ruiping Ji, Cynthia Zizola, Danielle L Brunjes, Yue Deng, Hirokazu Akashi, Hilary F Armstrong, Peter J Kennel, Tiffany Thomas, Daniel E Forman, Jennifer Hall, AalapChokshi, Matthew N Bartels, Donna Mancini, David Seres, P Christian Schulze. Journal Scan / Research · August 31, 2015
- R.W.Hong, J.D.Rounds,W. S. Helton,M. K. Robinson. Ann. Surg. 215:114, 1992
- Jyh-CherngYu, Z.M. Jiang, D.M. Li. World Journal of Gastroenterology 5[2] · April 1999 , 33
69.В.И. Кулинский, Л.С. Колесниченко . Биомедицинская химия, 2009 том 55, вып. 3, с. 255-277.
- C.H.Lillig,C. Berndt. [2013] Glutaredoxins in thiol/disulfide ex-change, Antioxidants & Redox Signaling, 18, 1654–65.
- В.В. Иванов, Е.В. Шахристова, Е.А. Степовая,О.Л. Носарева, Т.С. Федорова, Н.В. Рязанцева, В.В. Новицкий. Биохимия, 2015, том 80, вып. 1, с. 111 – 122.
- Е. С. Северин, ред. Биохимия: Учебник для мед.вузов М.: ГЭОТАР-МЕД, 2003.
- H. Gerster. Can adults adequately convert alpha-linolenic acid [18:3n-3] to eicosapentaenoic acid [20:5n-3] and docosahexaenoic acid [22:6n-3]?. Int J VitamNutr Res. 1998 68 [3]: 159–73.
- J.T. Brenna.CurrOpin Clin NutrMetab Care 2002, 5 [2]: 127-32. PMID 11844977.
- R.T. Holman .JNutr. 1998, 128 [2]: 427S-433S. PMID 9478042.
- В.И.Кулинский, Л.С. Колесниченко.Успехибиол. химии, 1990, 31, 157-179.
- P. Furst, K. Pogan ,P. StehleP. Nutrition 1997; 13:731-737
- А. В. Дмитриев, Л. М. Гунина. Основы спортивной нутрициологии. Спб.,2018, с. 194-204
- Roth E. Immune and cell modulation by amino acids. Clin. Nutr. 2007, 26:535–544.
- Roth E. Nonnutritive Effects of Glutamine. The Journal of Nutrition. 7th Amino Acid Assessment Workshop. 2008, 138: 2025S–2031S.




